题目内容
【题目】SiC纤维单向增强的TixAly基复合材料可作为高超音速飞行器表面的放热材料。回答下列问题:
(1)C元素所在周期中,第一电离能最大的元素是__(填元素符号),电负性最大的是__(填元素符号)。
(2)基态Ti原子的价电子排布式为__,能量最高的能级有__个空轨道。
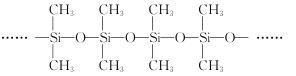
(3)甲基硅油结构如图所示,其中Si原子的杂化方式为__。以甲基硅油为主要成分的硅橡胶能够耐高温的原因是__。
(4)Li2CO3、Li2TiO3是锂离子电池中的常用材料,其中CO32-的空间构型为__,其含有的共价键类型有__。
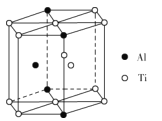
(5)TixAly合金的一种结构单元如图所示(Al、Ti原子各有一个原子在结构单元内部),该合金的化学式为__。其结构单元棱长为apm,底面边长为bpm,该合金的密度为___g·cm-3。
【答案】Ne F 3d24s2 3 sp3杂化 SiO键键能大 平面三角形 σ键、π键 Ti11Al5 ![]()
【解析】
(1)根据第一电离能及电负性周期性变化规律分析解答;
(2)根据电子排布规律、Ti的原子序数可以得出基态Ti原子价电子排布式、能量最高的能级空轨道数目;
(3)按Si原子形成的共价键种类和数目,确定Si原子的杂化方式;硅橡胶能够耐高温反化学键牢固程度来分析;
(4)根据价电子对互斥理论来确定C原子的杂化方式以及C原子与O原子之间的化学键类型;
(5)用均摊法计算晶胞的化学式,按合金的密度即晶胞密度、应用密度的定义计算。
(1) 随着原子序数的递增,同一周期的主族元素第一电离能呈递增趋势,碱金属的第一电离能最小,而稀有气体的第一电离能最大,C元素所在的周期为第二周期,则该周期Ne的第一电离能最大;
答案为:Ne;
除稀有气体外,同一周期主族元素的电负性从左到右逐渐增大,C元素所在的周期为第二周期,则该周期电负性最大的元素是F;
答案为:F;
(2) Ti的原子序数为22,基态Ti原子的电子排布式为[Ar] 3d24s2,价电子排布式为3d24s2,能量最高的能级为3d;
答案为:3d;
3d轨道共有五个,按洪特规则,其中有2个轨道分别被2个电子占据,还含有3个空轨道;
答案为:3;
(3)甲基硅油结构中Si原子形成4个单键,故Si原子的杂化方式为sp3杂化;
答案为:sp3杂化;
硅橡胶能够耐高温,原因是共价键牢固,硅橡胶中含SiO和SiC,SiO更牢固;
答案为:SiO键键能大;
(4) CO32-中C原子价电子对数=![]() ,且不含孤电子对,故C原子的杂化方式为sp2杂化,CO32-空间构型为平面三角形;
,且不含孤电子对,故C原子的杂化方式为sp2杂化,CO32-空间构型为平面三角形;
答案为:平面三角形;
由于CO32-空间构型为平面三角形,则C原子与O原子之间存在3个σ键和1个大π键;
答案为:σ键、π键;
(5)Ti原子在结构单元中的位置:顶点8个、面心2个、棱上1个、 体内1个,则![]() ,Al原子在顶点有4个,体内1个,则
,Al原子在顶点有4个,体内1个,则![]() ,则化学式为:Ti11Al5;
,则化学式为:Ti11Al5;
答案为:Ti11Al5;
则晶胞的密度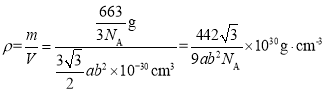 ;
;
答案为:![]() 。
。