题目内容
4.前20号元素A、B、C、D,其中A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C.(1)C在周期表中的位置第三周期第ⅥA族;
(2)B 元素的原子结构示意图
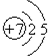 ;
;(3)化合物D2C的电子式
 ;
;(4)B最简单气态氢化物与最简单的有机物的稳定性强弱关系(用相应的化学式表示):NH3>CH4;
(5)C、D离子的半径大小关系为C>D (填:>、=、<);
(6)B的氢化物与B的最高价氧化物对应水化物反应的生成物中含有的化学键有B(填选项).
A、只含离子键 B、既有离子键又有共价键
C、只含有共价键 D、既有极性共价键又有非极性共价键.
分析 前20号元素A、B、C、D,A元素所处的周期数、主族序数、原子序数均相等,则A为H元素;B的原子半径是其所在主族中最小的,处于第二周期,B的最高价氧化物对应水化物的化学式为HBO3,最高正化合价为+5,处于ⅤA族,则B为N元素;C元素原子的最外层电子数比次外层少2个,则C应有三个电子层,最外层电子数为6,则C为S元素;C的阴离子与D的阳离子具有相同的电子排布,离子核外电子数为18,两元素可形成化合物D2C,D在第四周期第ⅠA族,则D为K,据此进行解答.
解答 解:A、B、C、D 4种元素,A元素所处的周期数、主族序数、原子序数均相等,则A为H元素;B的原子半径是其所在主族中最小的,处于第二周期,B的最高价氧化物对应水化物的化学式为HBO3,最高正化合价为+5,处于ⅤA族,则B为N元素;C元素原子的最外层电子数比次外层少2个,则C应有三个电子层,最外层电子数为6,则C为S元素;C的阴离子与D的阳离子具有相同的电子排布,离子核外电子数为18,两元素可形成化合物D2C,D在第四周期第ⅠA族,则D为K,
(1)由以上分析,C为S元素,位于元素周期表中第三周期第ⅥA族,故答案为:第三周期第ⅥA族;
(2)B为N元素,其原子序数为7,氮原子的原子结构示意图为: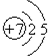 ,故答案为:
,故答案为: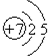 ;
;
(3)D2C为K2S,属于离子化合物,含有离子键,其电子式为: ,故答案为:
,故答案为: ;
;
(4)B的氢化物为氨气,最简单的有机物为甲烷,非金属性N>C,则二者的稳定性:NH3>CH4,故答案为:NH3;CH4;
(5)C为S、D为K,离子的电子层越多,离子半径越大,电子层相同时,核电荷数越大,离子半径越小,硫离子比钾离子的电子层相同,钾离子的核电荷数大于硫离子,则硫离子半径大于钾离子,即:C>D,
故答案为:>;
(6)B的氢化物为氨气,B的最高价氧化物对应水化物为硝酸,二者反应的生成物为硝酸铵,硝酸铵为离子化合物,其化学式中既含有离子键,也含有共价键,故B正确,
故答案为:B.
点评 本题考查了位置、结构与性质关系的综合应用,题目难度中等,推断各元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,明确比较粒子比较大小的方法.

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案| A. | CCl4可由CH4制得,可萃取碘水中的碘 | |
| B. | 苯不能使KMnO4溶液褪色,因此苯不能发生氧化反应 | |
| C. | 乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别 | |
| D. | 石油和天然气的主要成分都是碳氢化合物 |
①C4H8O2属于酯类的同分异构体有4种;
②
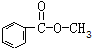 属于酯类的同分异构体还有4种;
属于酯类的同分异构体还有4种;③C7H8O遇氯化铁溶液呈紫色的同分异构体有3种
④C5H10O能发生银镜反应的同分异构体有3种.
| A. | ①② | B. | ③④ | C. | ①③ | D. | ②④ |
| A. | 海水$\stackrel{NaOH}{→}$Mg(OH)2$\stackrel{电解}{→}$Mg | |
| B. | 海水$\stackrel{HCl}{→}$ MgCl2溶液→MgCl2熔融$\stackrel{电解}{→}$Mg | |
| C. | 海水$\stackrel{石灰乳}{→}$Mg(OH)2$\stackrel{灼热}{→}$ MgO$\stackrel{电解}{→}$ Mg | |
| D. | 海水$\stackrel{石灰乳}{→}$Mg(OH)2$\stackrel{HCl}{→}$MgCl2溶液→MgCl2熔融$\stackrel{电解}{→}$Mg |
| A. | H2S | B. | CO2 | C. | SO2 | D. | H2 |
| Ⅰ除杂实验 | Ⅱ试剂 | Ⅲ操作方法 | 答案 | ||
| Ⅰ | Ⅱ | Ⅲ | |||
| ①苯(苯酚) | A.饱和Na2CO3溶液 B.NaCl晶体 C.NaOH溶液 D.CaO | a.蒸馏 b.分液 c.盐析、过滤 d.萃取 | ① | ||
| ②乙醇(水) | ② | ||||
| ③肥皂(甘油、水) | ③ | ||||
| ④乙酸乙酯(乙酸) | ④ | ||||
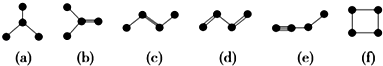
①有机物(a)有一种同分异构体,试写出其结构简式CH3CH2CH2CH3.
②上述有机物中与(c)互为同分异构体的是(b)(f)(填代号).
③任写一种与(e)互为同系物的有机物的结构简式CH≡CH.
④(a)(b)(c)(d)(e)五种物质中,4个碳原子一定处于同一平面的有(b)(c)(e)(填代号).
(3)下列实验中,需要用水浴加热的是②⑥,
①新制Cu(OH)2与乙醛反应; ②银镜反应; ③溴乙烷的水解;
④乙酸和乙醇反应制乙酸乙酯;⑤由乙醇制乙烯;⑥苯的硝化.
 ;
;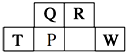 短周期元素Q、R、T、P、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、P、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题: ,用化学方程式表示工业上冶炼该单质的反应原理2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑.
,用化学方程式表示工业上冶炼该单质的反应原理2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑. ,实验室检验该氢化物的方法是ks5u用镊子夹住湿润的红色石蕊试纸靠近气体,观察到试纸变蓝或用蘸有浓盐酸的玻璃棒靠近气体,观察到有白烟产生.
,实验室检验该氢化物的方法是ks5u用镊子夹住湿润的红色石蕊试纸靠近气体,观察到试纸变蓝或用蘸有浓盐酸的玻璃棒靠近气体,观察到有白烟产生.