题目内容
12.1.38g该有机物在纯氧中完全燃烧,可生成3.08g二氧化碳和0.54g水,同时消耗氧气2.24g.又知0.224L此有机物蒸气(已折算成标准状况下)的质量为1.38g.(1)求此有机物的分子式.
(2)此有机物有多种同分异构体,且满足下列3个条件:
(i)遇FeCl3溶液显紫色
( ii)能与NaHCO3溶液反应
(ⅲ)除苯环外无其它环状结构
请任意写出1种符合条件的此有机物的结构简式
 ;
;(3)1mol此有机物分别与足量的碳酸氢钠溶液、氢氧化钠溶液反应理论上消耗二者的物质的量之比是1:2.(要有计算过程)
分析 (1)根据n=VVmVVm、n=mMmM分别计算出该有机物的物质的量、生成二氧化碳和水的物质的量,然后利用质量守恒定律确定其分子式;
(2)(i)遇FeCl3溶液显紫色,说明分子中含有酚羟基;(ii)能与NaHCO3溶液反应,说明分子中含有羧基;(ⅲ)除苯环外无其它环状结构,结合该有机物的分子式写出其结构简式;
(3)羧基能够与碳酸氢钠和氢氧化钠反应,而酚羟基只与强氧化钠反应,不与碳酸氢钠反应,据此进行计算.
解答 解:(1)标况下0.224L气体的物质的量为:0.224L22.4L/mol0.224L22.4L/mol=0.01mol,即:1.38g该有机物的物质的量为0.01mol,则其摩尔质量为:1.38g0.01mol1.38g0.01mol=138g/mol,
3.08g二氧化碳的物质的量为:3.08g44g/mol3.08g44g/mol=0.07mol,该有机物分子中含有C原子数为:N(C)=0.07mol0.01mol0.07mol0.01mol=7,
0.54g水的物质的量为:0.54g18g/mol0.54g18g/mol=0.03mol,则该有机物分子中含有H原子数为:N(H)=0.03mol×20.01mol0.03mol×20.01mol=6,
该有机物分子中含有C、H总原子量为:12×7+1×6=90<138,则该有机物中含有氧元素,其分子中含有氧原子的数目为:138−9016138−9016=3,
所以该有机物的分子式为:C7H6O3,
答:该有机物的分子式为C7H6O3;
(2)该有机物的分子式为C7H6O3,其不饱和度为:7×2+2−627×2+2−62=,5,(i)遇FeCl3溶液显紫色,说明其分子中含有酚羟基;(ii)能与NaHCO3溶液反应,说明分子中含有羧基;(ⅲ)除苯环外无其它环状结构,则该有机物分子中含有1个苯环,苯环上含有羟基和羧基,存在邻、间、对3种结构,则其可能的结构简式如: ,
,
故答案为: ;
;
(3)1mol该有机物分子中含有1mol羧基、1mol酚羟基,羧基和酚羟基都能够与氢氧化钠反应,而只有羧基与碳酸氢钠溶液反应,所以1mol该有机物能够消耗2molNaOH、1mol碳酸氢钠,
所以1mol该有机物与碳酸氢钠、强氧化钠完全反应理论上消耗二者的物质的量之比为:1mol:2mol=1:2,
故答案为:1:2.
点评 本题考查了有机物分子式、结构简式的确定,题目难度中等,明确常见有机物结构与性质为解答关键,注意掌握质量守恒定律在确定有机物分子式中的应用方法.

 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案| A. | 可用25 mL碱式滴定管量取20.00 mL KMnO4溶液 | |
| B. | 除去乙醇中少量的乙酸:加足量生石灰,蒸馏 | |
| C. | 用苯萃取溴水中的溴,分液时有机层从分液漏斗的下口放出 | |
| D. | 向SO2水溶液中滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,说明BaSO3难溶于盐酸 |
| A. | 氮族元素的氢化物中,NH3的沸点最低 | |
| B. | 非金属性:Cl>Br>I,所以酸性:HCl>HBr>HI | |
| C. | Na和Cs同主族,所以NaCl和CsCl晶胞的结构相同 | |
| D. | O和S同主族,所以CO2和CS2都是直线型非极性分子 |
| A. | 1mol•L-1的FeCl3 溶液中Fe3+个数少于NA | |
| B. | 46gNO2 中含有N原子数为NA | |
| C. | 17g羟基(-OH)与17gOH-所含电子数均为10 NA | |
| D. | 8.4g Fe与标准状况下3.36LCl2充分反应,转移电子数为0.3 NA,生成FeCl2 |
| 成分 | 质量(g) | 摩尔质量(g/mol) |
| 蔗糖 | 25.00 | 342 |
| 硫酸钾 | 0.25 | 174 |
| 阿司匹林 | 0.17 | 180 |
| 高锰酸钾 | 0.25 | 158 |
| 硝酸银 | 0.02 | 170 |
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸银
(2)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为:0.25128+0.25174×20.50.25128+0.25174×20.5 mol•L-1.(要求用原始数据书写出表达式,不需要化简)
(3)为了研究不同浓度的“鲜花保鲜剂”的保鲜功效,需配制多份不同物质的量浓度的溶液进行研究.现欲配制480mL某物质的量浓度的“鲜花保鲜剂”,所需的玻璃仪器有:烧杯、玻璃棒、500mL容量瓶、胶头滴管.(在横线上填写所缺仪器的名称)
(4)配制上述“鲜花保鲜剂”时,其正确的操作顺序是(用字母表示,每个操作只用一次):G→B→C→A→F→E→D;
A.用少量水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.在烧杯中加入适量水溶解
C.将烧杯中的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀,装入贴有标签的试剂瓶
E.改用胶头滴管加水,使溶液的凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度1-2cm处
G.用电子天平称量各组成成分,并把它们放入烧杯中混合
(5)在溶液配制过程中,下列操作使溶液浓度偏小的是:AD.
A.定容时仰视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的“鲜花保鲜剂”而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,再用胶头滴管加水至刻度线.
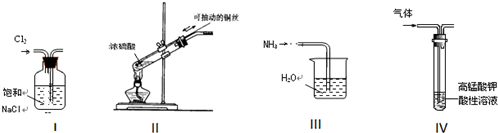
| A. | 实验Ⅰ:除去Cl2中的HCl | B. | 实验Ⅱ:使反应符合绿色化要求 | ||
| C. | 实验Ⅲ:吸收NH3 | D. | 实验Ⅳ:除去CO2中混有的SO2 |

 ;
; ;
; ;
; 分子中含氧官能团的名称是醛基;该有机物发生加聚反应后,所得产物的结构简式为
分子中含氧官能团的名称是醛基;该有机物发生加聚反应后,所得产物的结构简式为 .
.