题目内容
14. 短周期元素Q、R、T、P、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、P、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:(1)T的原子结构示意图为
 ,用化学方程式表示工业上冶炼该单质的反应原理2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑.
,用化学方程式表示工业上冶炼该单质的反应原理2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑.(2)元素的非金属性:Q>P(填“>”或“<”),可以证明该结论的实验是(用化学方程式表示)Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3.
(3)R的氢化物的结构式为
 ,实验室检验该氢化物的方法是ks5u用镊子夹住湿润的红色石蕊试纸靠近气体,观察到试纸变蓝或用蘸有浓盐酸的玻璃棒靠近气体,观察到有白烟产生.
,实验室检验该氢化物的方法是ks5u用镊子夹住湿润的红色石蕊试纸靠近气体,观察到试纸变蓝或用蘸有浓盐酸的玻璃棒靠近气体,观察到有白烟产生.(4)W在周期表的位置为第三周期第ⅥA族.W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,该气体的化学式为SO2.利用该气体的还原性,在海水提溴的过程中用该气体的水溶液吸收用空气吹出的溴蒸气.
分析 根据短周期元素Q、R、T、W在元素周期表中的位置知,Q和R位于第二周期、T和W位于第三周期,T所处的周期序数与主族序数相等,则T是Al元素,可推知P为Si元素、Q为C元素、R为N元素、W是S元素,
(1)T为Al元素,原子核外有13个电子,各层电子数为2、8、3;主族元素周期数=电子层数、主族族序数=最外层电子数,工业上电解氧化铝制铝;
(2)同主族元素从上向下,非金属性增强,非金属性越强,对应的最高价氧化物的水化物酸性越强;
(3)氨分子中有三个氮氢键,一对孤电子对,水溶液呈碱性,可以用湿润的红色石蕊试纸检验;
(4)硫原子核外有三个电子层,最外层电子数为6,硫和浓硫酸反应可以生成二氧化硫,由于二氧化硫有还原性,所以可以用二氧化硫的水溶液吸收用空气吹出的溴蒸气.
解答 解:根据短周期元素Q、R、T、W在元素周期表中的位置知,Q和R位于第二周期、T和W位于第三周期,T所处的周期序数与主族序数相等,则T是Al元素,可推知P为Si元素、Q为C元素、R为N元素、W是S元素,
(1)T为Al元素,原子核外有13个电子,各层电子数为2、8、3,所以铝的原子结构示意图为 ,工业上电解氧化铝制铝,反应的方程式为2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑,
,工业上电解氧化铝制铝,反应的方程式为2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑,
故答案为: ;2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑;
;2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑;
(2)同主族元素从上向下,非金属性增强,所以元素的非金属性:Q>P,非金属性越强,对应的最高价氧化物的水化物酸性越强,可以证明该结论的反应方程是Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3,
故答案为:>;Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3;
(3)氨分子中有三个氮氢键,一对孤电子对,所以氨分子的结构式是 ,水溶液呈碱性,可以用湿润的红色石蕊试纸检验,操作为用镊子夹住湿润的红色石蕊试纸靠近气体,观察到试纸变蓝或用蘸有浓盐酸的玻璃棒靠近气体,观察到有白烟产生,
,水溶液呈碱性,可以用湿润的红色石蕊试纸检验,操作为用镊子夹住湿润的红色石蕊试纸靠近气体,观察到试纸变蓝或用蘸有浓盐酸的玻璃棒靠近气体,观察到有白烟产生,
故答案为: ;用镊子夹住湿润的红色石蕊试纸靠近气体,观察到试纸变蓝或用蘸有浓盐酸的玻璃棒靠近气体,观察到有白烟产生;
;用镊子夹住湿润的红色石蕊试纸靠近气体,观察到试纸变蓝或用蘸有浓盐酸的玻璃棒靠近气体,观察到有白烟产生;
(4)硫原子核外有三个电子层,最外层电子数为6,在周期表的位置是第三周期第ⅥA族,硫和浓硫酸反应可以生成二氧化硫,由于二氧化硫有还原性,所以可以用二氧化硫的水溶液吸收用空气吹出的溴蒸气,
故答案为:第三周期第ⅥA族;SO2;还原.
点评 本题考查了元素周期表和元素周期律的应用,题目难度中等,根据信息推断各元素为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生灵活应用基础知识的能力.

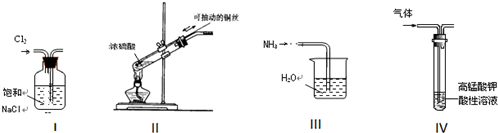
| A. | 实验Ⅰ:除去Cl2中的HCl | B. | 实验Ⅱ:使反应符合绿色化要求 | ||
| C. | 实验Ⅲ:吸收NH3 | D. | 实验Ⅳ:除去CO2中混有的SO2 |
| A. | 乙烯使酸性高锰酸钾溶液褪色 | |
| B. | 将苯滴入溴水中,振荡后水层接近无色 | |
| C. | 甲烷与氯气混合光照,混合气体颜色变浅 | |
| D. | 乙烯使溴的四氯化碳溶液褪色 |
| 离子 | Cu2+ | Al3+ | NO3- | Cl- |
| 物质的量浓度(mol•L-1) | 1 | 0.1 | a | 1 |
| A. | 电解后溶液的pH=14 | B. | a=0.3 | ||
| C. | 阳极生成1.5 mol Cl2 | D. | 阴极滴加酚酞会变红 |
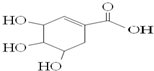
| A. | 可发生加成和取代反应 | |
| B. | 分子式为C7H6O5 | |
| C. | 分子中含有2种官能团 | |
| D. | 在水溶液中羧基和羟基均能电离出H+ |
 ;
; ;
;
 .
. 请完成下列各题:
请完成下列各题: