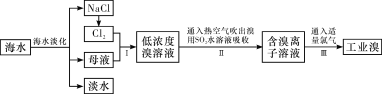
题目内容
【题目】硅是重要的半导体材料,构成了现代电子工业的基础。请回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为 ,该能层具有的原子轨道数为 、电子数为 。
(2)硅主要以硅酸盐、 等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以 相结合,其晶胞中共有8个原子,其中在面心位置贡献 个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为 。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
化学键 | C—C | C—H | C—O | Si—Si | Si—H | Si—O |
键能/(kJmol-1 | 356 | 413 | 336 | 226 | 318 | 452 |
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是 。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是 。
(6)在硅酸盐中,SiO4- 4四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为 ,Si与O的原子数之比为 ,化学式为 。

【答案】(1)M;9;4
(2)二氧化硅
(3)共价键;3
(4)Mg2Si + 4NH4Cl = SiH4 + 4NH3 + 2MgCl2
(5)①C—C键和C—H键较强,所形成的烷烃稳定。而硅烷中Si—Si键和Si—H键的键能较低,易断裂,导致长链硅烷难以生成。
②C—H键的键能大于C—O键,C—H键比C—O键稳定。而Si—H键的键能却远小于Si—O键,所以Si—H键不稳定而倾向于形成稳定性更强的Si—O键。
(6)sp3;1∶3;SiO32-(或表示为(SiO)n2n-)
【解析】
试题分析:
(1)硅原子核外有14个电子,其基态原子的核外电子排布式为1s22s22p63s23p2 ,对应能层分别别为K、
L、M,其中能量最高的是最外层M层,该能层有s、p、d三个能级,s能级有1个轨道,p能级
有3个轨道,d能级有5个轨道,所以共有9个原子轨道,硅原子的M能层有4个电子(3s23p2)。
故答案为:M;9;4;
(2)硅元素在自然界中主要以化合态(二氧化硅和硅酸盐)形式存在。
故答案为:二氧化硅;
(3)硅晶体和金刚石晶体类似都属于原子晶体,硅原子之间以共价键结合;硅晶胞中每个顶点上有1
个Si、面心是有1个Si、在晶胞内部含有4个Si原子,利用均摊法知,面心提供的硅原子个数
=6×![]() =3。
=3。
故答案为:共价键;3;
(4)Mg2Si和NH4Cl在液氨介质中反应制得SiH4、NH3和MgCl2,方程式为:Mg2Si+4NH4Cl= SiH4+
4NH3+2MgCl2。
故答案为:Mg2Si+4NH4Cl=SiH4+4NH3+2MgCl2;
(5)①烷烃中的C-C键和C-H键大于硅烷中的Si-Si键和Si-H键的键能,所以硅烷中Si-Si键和Si-H
键的键能易断裂,导致长链硅烷难以生成。
故答案为:C-C键和C-H键较强,所形成的烷烃稳定,而硅烷中Si-Si键和Si-H键的键能较低,易断裂,导致长链硅烷难以生成;
②键能越大、物质就越稳定,C-H键的键能大于C-O键,故C-H键比C-O键稳定,而Si-H键的
键能远小于Si-O键,所以Si-H键不稳定而倾向与形成稳定性更强的Si-O键。
故答案为:C-H键的键能大于C-O键,C-H键比C-O键稳定,而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键;
(6)硅酸盐中的硅酸根(SiO44-)为正四面体结构,所以中心原子Si原子采取了sp3杂化方式;根据图
(b)可以看出,每个结构单元中都有两个氧原子被两个单元共用,所以每个结构单元中相当于含
有1个硅原子、3个氧原子,Si与O的原子数之比为1:3,化学式为SiO32-(或表示为(SiO)n2n-)。
故答案为:sp3 ;1:3;SiO32-(或表示为(SiO)n2n-)。

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案