题目内容
【题目】用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A.0.01molNH4+含有质子数为0.1NA
B.4.48 L N2与CO的混合物所含分子数为0.2NA
C.6.2 g白磷与红磷的混合物中所含磷原子数为0.2NA
D.10.0mL 12 mol·L-1浓盐酸与足量二氧化锰反应,转移电子数为0.06NA
【答案】C
【解析】
A选项,1个NH4+含有11个质子,因此0.01molNH4+含有质子数为0.11NA,故A错误;
B选项,没有标准状况,无法计算物质的量,故B错误;
C选项,用极限思维思考,6.2 g白磷物质的量![]() ,含磷的物质的量为0.2mol,含磷原子数为0.2NA,6.2g红磷物质的量
,含磷的物质的量为0.2mol,含磷原子数为0.2NA,6.2g红磷物质的量![]() ,含磷原子数为0.2NA,故C正确;
,含磷原子数为0.2NA,故C正确;
D选项,10.0mL 12 mol·L-1浓盐酸物质的量为0.12mol,与足量二氧化锰反应,由于浓盐酸再反应过程中逐渐变稀后就不再反应,因此转移电子数小于0.06NA,故D错误;
综上所述,答案为C。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案【题目】Bodensteins研究反应H2(g)+I2(g)![]() 2HI(g) △H<0 ,温度为T时,在两个体积均为1L的密闭容器中进行实验,测得气体混合物中碘化氢的物质的量分数w(HI)与反应时间t的关系如下表:
2HI(g) △H<0 ,温度为T时,在两个体积均为1L的密闭容器中进行实验,测得气体混合物中碘化氢的物质的量分数w(HI)与反应时间t的关系如下表:
容器编号 | 起始物质 | t/min | 0 | 20 | 40 | 60 | 80 | 100 |
Ⅰ | 0.5molI2、0.5molH2 | w(HI)/% | 0 | 50 | 68 | 76 | 80 | 80 |
Ⅱ | xmolHI | w(HI)/% | 100 | 91 | 84 | 81 | 80 | 80 |
研究发现上述反应中:v正=kaw(H2)w(I2),v逆=kbw2(HI),其中ka、kb为常数。下列说法不正确的是( )
A. 温度为T时,该反应![]() =64
=64
B. 容器I中在前20min的平均速率v(HI)=0.025molL-1min-1
C. 若起始时,向容器I中加入物质的量均为0.1mol的H2、I2、HI,反应逆向进行
D. 无论x为何值,两容器中达平衡时w(HI)%均相同
【题目】在花瓶中加入“鲜花保鲜剂”可延长鲜花的寿命。下表是1 L“鲜花保鲜剂”的成分,阅读后并回答下列问题:
成分 | 质量/g | 摩尔质量/(g·mol-1) |
蔗糖 | 50.00 | 342 |
硫酸钾 | 0.50 | 174 |
阿司匹林 | 0.35 | 180 |
高锰酸钾 | 0.50 | 158 |
硝酸银 | 0.04 | 170 |
(1)“鲜花保鲜剂”中物质的量浓度最大的成分是__________(填写名称)。
(2)“鲜花保鲜剂”中K+的物质的量浓度为(阿司匹林中不含K+)__________________(只要求写表达式,不需计算)mol·L-1。
(3)下图所示的仪器中,在配制“鲜花保鲜剂”溶液时肯定不需要的是________(填字母),还缺少的玻璃仪器有__________________(填仪器名称)。
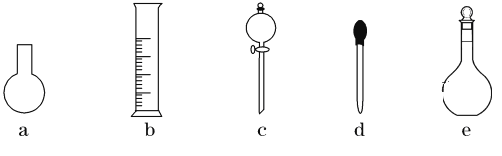
(4)配制过程中,下列操作对配制结果没有影响的是__________(填字母)。
A.容量瓶在使用前未干燥,里面有少量蒸馏水
B.定容时仰视液面
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(5)欲确定“鲜花保鲜剂”中硝酸银的浓度,可加入的试剂中要含有__________。(填化学符号)
【题目】实验室制取氯气除了用浓盐酸和二氧化锰反应外还可利用下列反应:KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O,该反应的优点是反应产生氯气速度快、不需加热。下图是实验室利用此反应制备氯气并进行一系列相关实验的装置(夹持设备已略)。
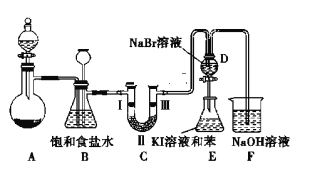
(1)装置B的作用是______ ,实验进行时C中可能发生堵塞,请写出发生堵塞时B中的现象:_______。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入______ (选“a”“b”或“c”)
a | b | c | |
Ⅰ | 干燥的有色布条 | 湿润的有色布条 | 干燥的有色布条 |
Ⅱ | 碱石灰 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(3)设计装置D、E 的目的是为了比较Cl2、Br2、I2的氧化性强弱.已知Br2的水溶液因浓度不同而呈现橙色或红棕色,I2难溶于水而易溶于苯,且I2的苯溶液为紫红色.当向D中缓缓通入足量Cl2时,可以看到无色溶液逐渐变为红棕色,说明Cl2的氧化性大于Br2,请写出D中对应的离子方程式并用单线桥法表示出电子转移情况:_________ 。打开活塞,将 D中的少量溶液加入E中,振荡E,观察到E中溶液分为两层,上层(苯层)为紫红色.该现象______ (填“能”或“不能”)说明 Br2的氧化性大于I2。
(4)装置F的作用是除去污染性的物质(Cl2、Br2等),已知 Cl2与NaOH反应时产物中可能有NaCl、NaClO、NaClO3,且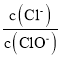 值与温度高低有关.若烧杯中装有500mL 0.2mol/L 的NaOH溶液,则最多可吸收标况下的Cl2的体积为______ L(忽略Cl2溶于水)。
值与温度高低有关.若烧杯中装有500mL 0.2mol/L 的NaOH溶液,则最多可吸收标况下的Cl2的体积为______ L(忽略Cl2溶于水)。