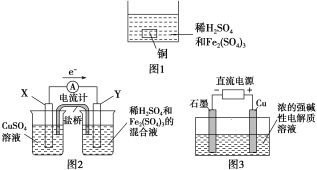
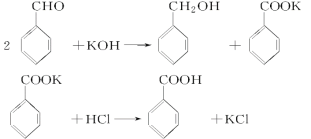
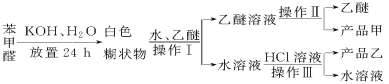
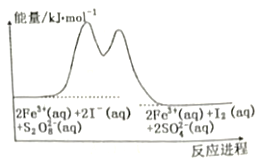
��Ŀ����
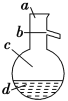
����Ŀ��ʵ������ȡ����������Ũ����Ͷ������̷�Ӧ����������з�Ӧ��KClO3+6HCl(Ũ)�TKCl+3Cl2��+3H2O���÷�Ӧ���ŵ��Ƿ�Ӧ���������ٶȿ졢������ȡ���ͼ��ʵ�������ô˷�Ӧ�Ʊ�����������һϵ�����ʵ���װ��(�г��豸����)��
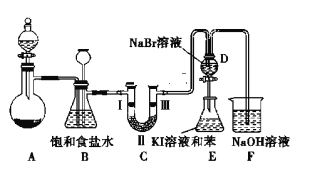
��1��װ��B��������______ ��ʵ�����ʱC�п��ܷ�����������д����������ʱB�е�����_______��
��2��װ��C��ʵ��Ŀ������֤�����Ƿ����Ư���ԣ�Ϊ��C�Т����η���______ (ѡ��a����b������c��)
a | b | c | |
�� | �������ɫ���� | ʪ�����ɫ���� | �������ɫ���� |
�� | ��ʯ�� | Ũ���� | ��ˮ�Ȼ��� |
�� | ʪ�����ɫ���� | �������ɫ���� | �������ɫ���� |
��3�����װ��D��E ��Ŀ����Ϊ�˱Ƚ�Cl2��Br2��I2��������ǿ������֪Br2��ˮ��Һ��Ũ�Ȳ�ͬ�����ֳ�ɫ�����ɫ��I2������ˮ�������ڱ�����I2�ı���ҺΪ�Ϻ�ɫ������D�л���ͨ������Cl2ʱ�����Կ�����ɫ��Һ��Ϊ����ɫ��˵��Cl2�������Դ���Br2����д��D�ж�Ӧ�����ӷ���ʽ���õ����ŷ���ʾ������ת�������_________ ���������� D�е�������Һ����E�У���E���۲쵽E����Һ��Ϊ���㣬�ϲ�(����)Ϊ�Ϻ�ɫ��������______ (������������������)˵�� Br2�������Դ���I2��
��4��װ��F�������dz�ȥ��Ⱦ�Ե�����(Cl2��Br2��)����֪ Cl2��NaOH��Ӧʱ�����п�����NaCl��NaClO��NaClO3����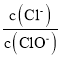 ֵ���¶ȸߵ��йأ����ձ���װ��500mL 0.2mol/L ��NaOH��Һ�����������ձ���µ�Cl2�����Ϊ______ L(����Cl2����ˮ)��
ֵ���¶ȸߵ��йأ����ձ���װ��500mL 0.2mol/L ��NaOH��Һ�����������ձ���µ�Cl2�����Ϊ______ L(����Cl2����ˮ)��
���𰸡���ȥ�����л��е��Ȼ��� ����©����Һ������ c ![]() ���� 1.12
���� 1.12
��������
Aװ��ʵ������ȡ������A��������ͬʱ����HCl�����ˮ������Bװ�ó���HCl���壬Cװ�ü���������Ư���ԣ�D��Eװ����֤�ȡ��塢��ķǽ�����ǿ����F��β������װ�á�
��A����������ͬʱ���ӷ���HCl�����װ��B�������dz�ȥ�����л��е��Ȼ��⣬ʵ�����ʱC�п��ܷ�����������д����������ʱB�е�����©����Һ���������ʴ�Ϊ����ȥ�����л��е��Ȼ��⣻����©����Һ��������
��װ��C��ʵ��Ŀ������֤�����Ƿ����Ư���ԣ���Ϊ��B�����������Ǻ���ˮ�����ģ��������۲����Ƿ�ʪ������ɫ�������Ǹ��������������ü�ʯ�ң���ʯ�һ�����������U�ܲ���װŨ���ᣬ����Ϊ�������ɫ���������c��ȷ��
��D�ж�Ӧ�����ӷ���ʽ���õ����ŷ���ʾ������ת�������![]() ��
��
��������D�е�������Һ����E�У���E���۲쵽E����Һ��Ϊ���㣬�ϲ�(����)Ϊ�Ϻ�ɫ��D�е�Һ���е����壬�������ж������������˸�������˵��Br2�������Դ���I2���ʴ�Ϊ![]() �����ܣ�
�����ܣ�
��Cl2 + 2NaOH = NaCl + NaClO + H2O��3Cl2 + 6NaOH = 5NaCl + NaClO3 + 3H2O�����ݷ�Ӧ����ʽ�ó������ĸ����̶���1 mol��������2 mol NaOH��Һ�����ձ���װ��500mL 0.2mol/L ��NaOH��Һ�����ʵ���![]() �����ĵ����������
�����ĵ����������![]() ���ó�x = 1.12 L���ʴ�Ϊ1.12 L��
���ó�x = 1.12 L���ʴ�Ϊ1.12 L��