��Ŀ����
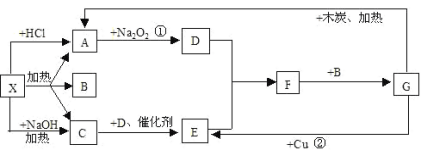
����Ŀ����ͼ�е�ÿһ�������ʾ�йص�һ�ַ�Ӧ������������A��CΪ��ɫ����
��1��д���й����ʵĻ�ѧʽX��_______��F_______
��2��д��A��D�Ļ�ѧ����ʽ____________����
��3��д��ʵ�����Ʊ�C�Ļ�ѧ����ʽ_______
��4��C�������Ʊ����أ�����CO(NH2)2�����ڸ��������������������ط���ˮ�⣬�����������壬��ˮ��Ļ�ѧ����ʽ��______
��5���ֱ�ȡ����50mLNaOH��Һ����������ͨ��һ����������A������ȡ��Һ10mL�ֱ���ϡ�͵���ͬ������õ���Һ���ң��ֱ����������μ���0.1mol/L��HCl��Һ��������A�����������״���£����������HCl�����֮��Ĺ�ϵ��ͼ��ʾ����
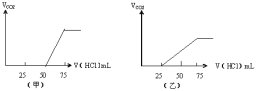
��NaOH������A�������ͼ��ʾ��Һ�д��ڵ������ǣ�_____�������ʵ���֮���ǣ�_________
��ԭNaOH��Һ�����ʵ���Ũ����_______mol/L����ͼ��ʾ��Һ��������A���Ϊ_____mL(��״��)��
���𰸡�NH4HCO3 �� (NH4)2CO3 NO2 2CO2+2Na2O2 =2Na2CO3+O2 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3��+2H2O CO(NH2)2+H2O=2NH3��+CO2�� NaHCO3��Na2CO3 1:1 0.75 112
CaCl2+2NH3��+2H2O CO(NH2)2+H2O=2NH3��+CO2�� NaHCO3��Na2CO3 1:1 0.75 112
��������
X���������ᷴӦ��������NaOH��Ӧ�����������壬ӦΪ������Σ���CΪNH3������A����������Ʒ�Ӧ����AΪCO2����XӦΪ(NH4)2CO3��NH4HCO3��BΪH2O�����ת����ϵ����֪����DΪO2��EΪNO��FΪNO2��GΪHNO3��������ʵ����ʽ��н��
��1���ɷ�����֪��XΪ(NH4)2CO3��NH4HCO3��FΪNO2���ʴ�Ϊ��(NH4)2CO3��NH4HCO3��NO2��
��2���ɷ�����֪��AΪCO2��DΪO2��Na2O2��CO2��Ӧ����O2����Ӧ����ʽΪ��2CO2+2Na2O2 =2Na2CO3+O2���ʴ�Ϊ��2CO2+2Na2O2 =2Na2CO3+O2��
��3��ʵ�����Ʊ������������Ȼ�������������ڼ��������·�Ӧ����Ӧ����ʽΪ��2NH4Cl+Ca(OH)2![]() CaCl2+2NH3��+2H2O���ʴ�Ϊ��2NH4Cl+Ca(OH)2
CaCl2+2NH3��+2H2O���ʴ�Ϊ��2NH4Cl+Ca(OH)2![]() CaCl2+2NH3��+2H2O��
CaCl2+2NH3��+2H2O��
��4�����ص�ˮ�������������壬������ص�Ԫ����ɣ������ɵ��ǰ����Ͷ�����̼���ʷ�ӦΪ��CO(NH2)2+H2O=2NH3��+CO2�����ʴ�Ϊ��CO(NH2)2+H2O=2NH3��+CO2����
��5��������CO2����ʱ��������ӦNaHCO3+HCl=NaCl+H2O+CO2����
�ټ��������̼��NaOH��Ӧ����Һ��ֻ��Na2CO3����ʼ������ӦNa2CO3+HCl=NaHCO3+NaCl����������Ӧ��NaHCO3+HCl=CO2��+NaCl+H2O��ǰ��������������������ȣ���ʵ��ǰ��������������������ֱ�Ϊ25mL��50mL��ǰ�������������С�ں�Σ���������NaHCO3��Na2CO3���ɷ�ӦNa2CO3+HCl=NaHCO3+NaCl������֪��n(Na2CO3)=n(HCl)=0.025L��0.1mol/L=0.0025mol�����ɵ�̼������Ϊ0.0025mol���ɷ�ӦNaHCO3+HCl=CO2��+NaCl+H2O������֪���ܵ�̼������Ϊ0.05L��0.1mol/L=0.05mol����ԭ��Һ��̼������Ϊ0.05mol-0.0025mol=0.0025mol�������ʵ���֮����1:1���ʴ�Ϊ��NaHCO3��Na2CO3��1:1��
�ڼ���75mL����ʱ����Һ�����ʶ�ǡ����ȫ��Ӧ����ʱ��ҺΪNaCl��Һ������Na��Cl�غ��֪10mL��Һ��n��NaOH��=n��NaCl��=n��HCl��=0.075L��0.1mol/L=0.0075mol����ԭ����������Һ��Ũ��=![]() =0.75mol/L�����ף�������CO2�������������HClΪ25mL����������̼��NaOH��Ӧ����Һ�в���NaHCO3����Na2CO3+HCl=NaHCO3+NaCl��֪����CO32-ת��ΪHCO3-Ӧ����HClΪ25mL����ͼ���п�ʼ����CO2����ʱ����HCl���Ϊ50mL��˵���ýλ�������ӦNaOH+HCl=NaCl+H2O����Һ������ΪNaOH��Na2COspan>3���к�NaOH����HCl�����Ϊ50mL-25mL=25mL��n(Na2CO3)=n(HCl)=0.025L��0.1mol/L=0.0025mol��n(NaOH)=n(HCl)=0.025L��0.1mol/L=0.0025mol�����ݷ�Ӧ����ʽ��Na2CO3+H2O+CO2=2NaHCO3��NaOH+CO2=NaHCO3����Һ��������CO2�����ʵ���Ϊ0.0025mol+0.0025mol=0.005mol���ڱ�״�������Ϊ0.005mol��22.4L/mol=112mL���ʴ�Ϊ��0.75mol/L��112��
=0.75mol/L�����ף�������CO2�������������HClΪ25mL����������̼��NaOH��Ӧ����Һ�в���NaHCO3����Na2CO3+HCl=NaHCO3+NaCl��֪����CO32-ת��ΪHCO3-Ӧ����HClΪ25mL����ͼ���п�ʼ����CO2����ʱ����HCl���Ϊ50mL��˵���ýλ�������ӦNaOH+HCl=NaCl+H2O����Һ������ΪNaOH��Na2COspan>3���к�NaOH����HCl�����Ϊ50mL-25mL=25mL��n(Na2CO3)=n(HCl)=0.025L��0.1mol/L=0.0025mol��n(NaOH)=n(HCl)=0.025L��0.1mol/L=0.0025mol�����ݷ�Ӧ����ʽ��Na2CO3+H2O+CO2=2NaHCO3��NaOH+CO2=NaHCO3����Һ��������CO2�����ʵ���Ϊ0.0025mol+0.0025mol=0.005mol���ڱ�״�������Ϊ0.005mol��22.4L/mol=112mL���ʴ�Ϊ��0.75mol/L��112��

 �Ǽ�����������ϵ�д�
�Ǽ�����������ϵ�д�����Ŀ����֪ij��ѧ��Ӧ��ƽ�ⳣ������ʽΪK��![]() ���ڲ�ͬ���¶��¸÷�Ӧ��ƽ�ⳣ�������ʾ�������й���������ȷ����( )
���ڲ�ͬ���¶��¸÷�Ӧ��ƽ�ⳣ�������ʾ�������й���������ȷ����( )
t/�� | 700 | 800 | 830 | 1 000 | 1 200 |
K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
A. �÷�Ӧ�Ļ�ѧ����ʽ��CO(g)��H2O(g)![]() CO2(g)��H2(g)
CO2(g)��H2(g)
B. ������Ӧ������Ӧ�Ƿ��ȷ�Ӧ
C. ����1 L���ܱ�������ͨ��CO2��H2��1 mol,5 min���¶����ߵ�830 �棬��ʱ���COΪ0.4 mol����÷�Ӧ�ﵽƽ��״̬
D. ��ƽ��Ũ�ȷ������й�ϵʽ��![]() ��
��![]() �����ʱ���¶�Ϊ1 000 ��
�����ʱ���¶�Ϊ1 000 ��



