��Ŀ����
����Ŀ��25��ʱ������ƽ�ⳣ����
��ѧʽ | CH3COOH | H2CO3 | HClO |
����ƽ�ⳣ�� | 1.8��10��5 | K1=4.3��10��7 K2=5.6��10��11 | 3.0��10��8 |
�ش��������⣺
��1����һ�����£�CH3COOH��Һ�д��ڵ���ƽ�⣺CH3COOH![]() CH3CH3COO��+H+ ��H��0 ,���з����У�����ʹ0.10mol��L��1CH3COOH��Һ��CH3COOH����̶��������_________��
CH3CH3COO��+H+ ��H��0 ,���з����У�����ʹ0.10mol��L��1CH3COOH��Һ��CH3COOH����̶��������_________��
a����������0.10mol��L��1��ϡ���� b������
c����ˮϡ����0.010mol��L��1 d����������������
��2�������ʵ���Ũ�ȵ�Na2CO3��NaClO��CH3COONa��NaHCO3��pH�ɴ�С��˳����____________��
��3��������0.1mol/L��CH3COOH��Һ��ˮϡ���̣����б���ʽ������һ����С����___________��
A��c��H+�� B��c��H+��/c��CH3COOH��
C��c��H+��c��OH���� D��c��OH����/c��H+��
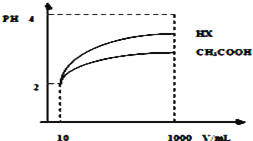
��4�����Ϊ10mLpH=2�Ĵ�����Һ��һԪ��HX�ֱ��ˮϡ����1000mL��ϡ����pH�仯��ͼ��ʾ����HX�ĵ���ƽ�ⳣ��____________��������������������������С�����������ƽ�ⳣ����ϡ�ͺ�HX��Һ��ˮ���������c��H+��______________������Һˮ�������c��H+����������������������������С��������
��5��25��ʱ��CH3COOH��CH3COONa�Ļ����Һ������û��ҺpH=6������Һ��c��CH3COO������c��Na+��=_________________����ȷ��ֵ����
���𰸡� bc Na2CO3��NaClO��NaHCO3 ��CH3COONa A ���� ���� 9.9��10��7mol/L
��������(1)����ĵ��������ȷ�Ӧ����ˮϡ�͡��������ȶ��ܴٽ�����ĵ��룬�ɴ˷����жϣ�
(2)�ɵ���ƽ�ⳣ���ж����Ե�ǿ��������Խǿ�����Ӧ�ε�ˮ��̶�Խ����Һ��pH��Խ��
(3)CH3COOH��Һ��ˮϡ���̣��ٽ����룬c(H+)��С��c(OH-)����Kw���䣻
(4)��ͼ��֪��ϡ����ͬ�ı�����HX��pH�仯�̶ȴ�������HXǿ������ƽ�ⳣ����ϡ�ͺ�HX�������ɵ�c(H+)С����ˮ�ĵ�����������С��
(5)25��ʱ�����ҺpH=6��c(H+)=1.0��10-6mol/L������Kw��֪��c(OH-)=1.0��10-8mol/L���ɵ���غ��֪��c(CH3COO-)-c(Na+)=c(H+)-c(OH-)��
(1)����ĵ��������ȷ�Ӧ����ˮϡ�͡��������ȶ��ܴٽ�����ĵ��룻a����������0.10molL-1��ϡ���ᣬ��Һ��������Ũ���������ƴ���ĵ��룬�����ĵ���̶Ƚ��ͣ��ʴ���b������ĵ��������ȷ�Ӧ������CH3COOH��Һ���ٽ�����ĵ��룬�����ĵ���̶�������ȷ��c����ˮϡ����0.010molL-1���ٽ�����ĵ��룬�����ĵ���̶�������ȷ��d���������������ᣬ����ĵ���ƽ��������Ӧ�����ƶ���������ĵ���̶Ƚ��ͣ��ʴ��ʴ�Ϊ��bc��
(2)�ɱ����е����ݿ�֪������CH3COOH��H2CO3��HClO��HCO3-����ˮ��̶�ΪNa2CO3��NaClO��NaHCO3 ��CH3COONa��pH�ɴ�С��˳����Na2CO3��NaClO��NaHCO3 ��CH3COONa���ʴ�Ϊ��Na2CO3��NaClO��NaHCO3 ��CH3COONa��
(3)A��CH3COOH��Һ��ˮϡ���̣��ٽ����룬c(H+)��С����Aѡ��B��CH3COOH��Һ��ˮϡ���̣��ٽ����룬c(H+)/c(CH3COOH)=n(H+)/n(CH3COOH)����ϡ�����б�ֵ���B��ѡ��C��ϡ���̣��ٽ����룬c(H+)��С��c(OH-)����c(H+)c(OH-)=Kw��Kw���䣬��C��ѡ��D��ϡ���̣��ٽ����룬c(H+)��С��c(OH-)������c(OH-)/c(H+)���D��ѡ���ʴ�Ϊ��A��
(4)��ͼ��֪��ϡ����ͬ�ı�����HX��pH�仯�̶ȴ�������HXǿ������ƽ�ⳣ����ϡ�ͺ�HX�������ɵ�c(H+)С����ˮ�ĵ�����������С������HX��Һ��ˮ���������c(H+)�ʴ�Ϊ�����ڣ�������
(5)25��ʱ�����ҺpH=6��c(H+)=1.0��10-6mol/L������Kw��֪��c(OH-)=1.0��10-8mol/L���ɵ���غ��֪��c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=9.9��10-7mol/L���ʴ�Ϊ��9.9��10-7mol/L��