题目内容
【题目】某不饱和烃与氢气加成后的产物为 ,请按要求回答下列问题:
,请按要求回答下列问题:
(1)请用系统命名法对该物质进行命名:_________________________。
(2)若该不饱和烃为炔烃,则该炔烃的结构简式为___________________________。
(3)若该不饱和烃为一单烯烃,则可能有________种结构,结构简式分别为__________。
(4)由(2)中炔烃的最简单同系物可以合成聚氯乙烯塑料。试写出该过程中的化学方程式,并注明反应类型:
①______________________________________;
②________________________________________________________________________。
【答案】2,2,5—三甲基己烷 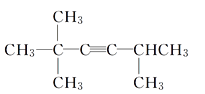 3
3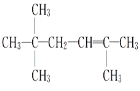
 HC≡CH+HCl
HC≡CH+HCl![]() CH2===CHCl 加成反应
CH2===CHCl 加成反应![]()
![]()
![]() 加聚反应
加聚反应
【解析】
(1)主链中含6个C,2、5号C上含甲基,则系统命名法命名为2,2,5-三甲基-己烷,故答案为:2,2,5-三甲基-己烷;(2)若该不饱和烃为炔烃,则相连的C至少各有2个H,存在1种可能的结构,如图中1、2位置 ,则该炔烃的结构简式为
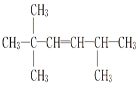
,则该炔烃的结构简式为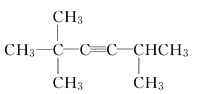 ;(3)该不饱和烃为一单烯烃,则相连的C至少各有1个H,存在3种可能的结构,如图中1、2、3位置
;(3)该不饱和烃为一单烯烃,则相连的C至少各有1个H,存在3种可能的结构,如图中1、2、3位置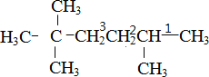 ,得到烯烃结构简式分别为
,得到烯烃结构简式分别为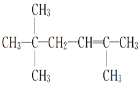 、
、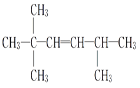 、
、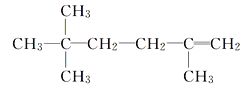 ;(4)炔烃的最简单同系物是乙炔,由乙炔转化为氯乙烯,氯乙烯发生加聚反应生成聚氯乙烯。发生反应及反应类型分别为①HC≡CH+HCl
;(4)炔烃的最简单同系物是乙炔,由乙炔转化为氯乙烯,氯乙烯发生加聚反应生成聚氯乙烯。发生反应及反应类型分别为①HC≡CH+HCl![]() CH2===CHCl,属于加成反应;②
CH2===CHCl,属于加成反应;②![]()
![]()
![]() ,属于加聚反应。
,属于加聚反应。

【题目】25℃时,电离平衡常数:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10﹣5 | K1=4.3×10﹣7 K2=5.6×10﹣11 | 3.0×10﹣8 |
回答下列问题:
(1)在一条件下,CH3COOH溶液中存在电离平衡:CH3COOH![]() CH3CH3COO﹣+H+ △H>0 ,下列方法中,可以使0.10mol·L﹣1CH3COOH溶液中CH3COOH电离程度增大的是_________。
CH3CH3COO﹣+H+ △H>0 ,下列方法中,可以使0.10mol·L﹣1CH3COOH溶液中CH3COOH电离程度增大的是_________。
a.加入少量0.10mol·L﹣1的稀盐酸 b.加热
c.加水稀释至0.010mol·L﹣1 d.加入少量冰醋酸
(2)等物质的量浓度的Na2CO3、NaClO、CH3COONa、NaHCO3的pH由大到小的顺序是____________。
(3)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是___________。
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)c(OH﹣) D.c(OH﹣)/c(H+)
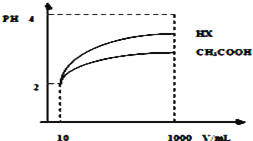
(4)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图所示.则HX的电离平衡常数____________(填“大于”、“等于”或“小于”)醋酸的平衡常数;稀释后,HX溶液中水电离出来的c(H+)______________醋酸溶液水电离出来c(H+)(填“大于”、“等于”或“小于”)。
(5)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO﹣)﹣c(Na+)=_________________(填准确数值)。
【题目】下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
(1)原子半径最小的元素是____(填元素名称),写出⑧的原子结构示意图______。
(2)最高价氧化物对应的水化物中,碱性最强的是___(用化学式回答,下同),酸性最强的是___。
(3)①与⑤形成的化合物中,化学键类型为_____。
(4)⑦与⑨形成的化合物的电子式为___,②与④形成的原子个数比为1:2的化合物的结构式为____。
(5)③、④、⑥的原子半径由大到小的顺序为_____(用元素符号回答)。
(6)为探究元素②和⑧的非金属性强弱,某同学设计了如图所示的装置进行实验(夹持仪器已略去,装置气密性良好)。请回答:

a.溶液B的作用是_______
b.若看到____现象,即可证明酸性_______(用化学式回答),则非金属性_______(用元素符号回答)。
c.上述实验中,能说明②和⑧非金属性强弱的化学方程式是_____________。
