题目内容
【题目】氢键对物质性质具有一定的影响,下列现象与氢键无关的是
A.水在结冰时体积膨胀
B.NH3比PH3热稳定性好
C.邻羟基苯甲醛沸点比对羟基苯甲醛低
D.甘油、浓硫酸都呈黏稠状
【答案】B
【解析】
根据题中氢键对物质性质的影响可知,本题考查氢键的应用,运用形成原理进行分析。
A. 冰中的氢键比液态水中的强,使得水分子排列得很规则,造成体积膨胀,A项错误;
B. NH3、PH3热分解断裂的是N-P键、P-H键,与氢键无关,B项正确;
C.邻羟基苯甲醛形成分子内氢键,使熔沸点相对较低,对羟基苯甲醛,形成分子间氢键,使熔沸点相对较高;C项错误;
D. 由于甘油、浓硫酸分子间可形成众多的氢键,一般粘度较大,呈黏稠状,D项错误;
答案选B。

 阅读快车系列答案
阅读快车系列答案【题目】25℃时,电离平衡常数:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10﹣5 | K1=4.3×10﹣7 K2=5.6×10﹣11 | 3.0×10﹣8 |
回答下列问题:
(1)在一条件下,CH3COOH溶液中存在电离平衡:CH3COOH![]() CH3CH3COO﹣+H+ △H>0 ,下列方法中,可以使0.10mol·L﹣1CH3COOH溶液中CH3COOH电离程度增大的是_________。
CH3CH3COO﹣+H+ △H>0 ,下列方法中,可以使0.10mol·L﹣1CH3COOH溶液中CH3COOH电离程度增大的是_________。
a.加入少量0.10mol·L﹣1的稀盐酸 b.加热
c.加水稀释至0.010mol·L﹣1 d.加入少量冰醋酸
(2)等物质的量浓度的Na2CO3、NaClO、CH3COONa、NaHCO3的pH由大到小的顺序是____________。
(3)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是___________。
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)c(OH﹣) D.c(OH﹣)/c(H+)
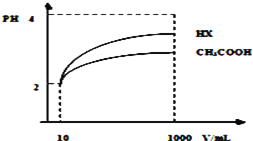
(4)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图所示.则HX的电离平衡常数____________(填“大于”、“等于”或“小于”)醋酸的平衡常数;稀释后,HX溶液中水电离出来的c(H+)______________醋酸溶液水电离出来c(H+)(填“大于”、“等于”或“小于”)。
(5)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO﹣)﹣c(Na+)=_________________(填准确数值)。