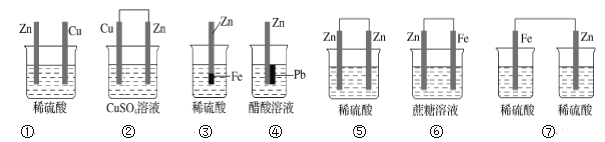
��Ŀ����
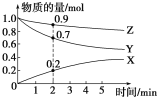
����Ŀ��(1)ij�¶�ʱ����2 L������X��Y��Z������������ʵ�����ʱ��仯��������ͼ��ʾ���ɴ˷������÷�Ӧ�Ļ�ѧ����_____________________________________���ӷ�Ӧ��ʼ��2 min��Z�ķ�Ӧ����Ϊ_____ mol��L-1��min-1��
(2)��������Ӧ�ġ�H<0,�����йظ÷�Ӧ���ʵ���������ȷ����_________��
A�������¶Ⱥ�����ѹǿ�������������Ӱٷ������ӿ췴Ӧ����
B��ʹ�ô�������ʹ��Ӧ�Ļ�ܽ��ͣ��ӿ췴Ӧ����
C������Ӽ�����������ײΪ��Ч��ײ
D�������¶ȣ�v����v������С��v����С�ı���С��v����С�ı���
(3)��һ�ܱ������з�����ӦN2(g)��3H2(g)![]() 2NH3(g)��H<0���ﵽƽ���ֻ�ı�ijһ������ʱ����Ӧ�����뷴Ӧʱ��Ĺ�ϵ��ͼ��ʾ�� t1��t3��t4ʱ�̷ֱ�ı��һ�������ǣ�
2NH3(g)��H<0���ﵽƽ���ֻ�ı�ijһ������ʱ����Ӧ�����뷴Ӧʱ��Ĺ�ϵ��ͼ��ʾ�� t1��t3��t4ʱ�̷ֱ�ı��һ�������ǣ�
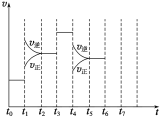
A������ѹǿ B����Сѹǿ C�������¶� D�������¶� E���Ӵ��� F�����뺤��
t1ʱ��________��t3ʱ��________��t4ʱ��________(����ĸ)��
���𰸡�Z+3Y![]() 2X 0.025 BD C E B
2X 0.025 BD C E B
��������
��1����ͼ���֪����Ӧ��Z��Y�����ʵ�����С��X�����ʵ���������Z��YΪ��Ӧ�XΪ�����
��2��A. �����¶ȿ����������Ӱٷ������ӿ췴Ӧ���ʣ�����������ߣ�ѹǿ�������������
B. ʹ�ô�������ʹ��Ӧ�Ļ�ܽ��ͣ��ӿ췴Ӧ���ʣ�
C. ����Ӽ�����������ײ��һ��������Ч��ײ�����ܹ�������ѧ�仯����ײ��Ϊ��Ч��ײ����C����
D. ��Ӧ�ġ�H<0�� v����v������С��v����С�ı���С��v����С�ı����������¶�ƽ�����ƶ���
��3���ı������Ϊt1ʱ�������¶ȣ�t3ʱ�̼Ӵ�����t4ʱ�̼�Сѹǿ��
��1����ͼ���֪����Ӧ��Z��Y�����ʵ�����С��X�����ʵ���������Z��YΪ��Ӧ�XΪ������ҡ�n(Z)����n(Y)����n(X)=0.1mol��0.3mol��0.2mol=1:3:2����Ӧ�Ļ�ѧ����ʽΪ��Z+3Y![]() 2X��v(Z)= ��c/��t=��0.1mol/2L��/2 min=0.025 mol��L-1��min-1���ʴ�Ϊ��Z+3Y
2X��v(Z)= ��c/��t=��0.1mol/2L��/2 min=0.025 mol��L-1��min-1���ʴ�Ϊ��Z+3Y![]() 2X��0.025��
2X��0.025��
��2��A. �����¶ȿ����������Ӱٷ������ӿ췴Ӧ���ʣ�����������ߣ�ѹǿ���������������A����
B. ʹ�ô�������ʹ��Ӧ�Ļ�ܽ��ͣ��ӿ췴Ӧ���ʣ���B��ȷ��
C. ����Ӽ�����������ײ��һ��������Ч��ײ�����ܹ�������ѧ�仯����ײ��Ϊ��Ч��ײ����C����
D. ��Ӧ�ġ�H<0�� v����v������С��v����С�ı���С��v����С�ı����������¶�ƽ�����ƶ�����D��ȷ��
��ѡBD��
��3���ı������Ϊt1ʱ�������¶ȣ�t3ʱ�̼Ӵ�����t4ʱ�̼�Сѹǿ���ʴ�Ϊ��C��E��B��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ��25��ʱ������ƽ�ⳣ����
��ѧʽ | CH3COOH | H2CO3 | HClO |
����ƽ�ⳣ�� | 1.8��10��5 | K1=4.3��10��7 K2=5.6��10��11 | 3.0��10��8 |
�ش��������⣺
��1����һ�����£�CH3COOH��Һ�д��ڵ���ƽ�⣺CH3COOH![]() CH3CH3COO��+H+ ��H��0 ,���з����У�����ʹ0.10mol��L��1CH3COOH��Һ��CH3COOH����̶��������_________��
CH3CH3COO��+H+ ��H��0 ,���з����У�����ʹ0.10mol��L��1CH3COOH��Һ��CH3COOH����̶��������_________��
a����������0.10mol��L��1��ϡ���� b������
c����ˮϡ����0.010mol��L��1 d����������������
��2�������ʵ���Ũ�ȵ�Na2CO3��NaClO��CH3COONa��NaHCO3��pH�ɴ�С��˳����____________��
��3��������0.1mol/L��CH3COOH��Һ��ˮϡ���̣����б���ʽ������һ����С����___________��
A��c��H+�� B��c��H+��/c��CH3COOH��
C��c��H+��c��OH���� D��c��OH����/c��H+��
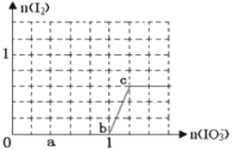
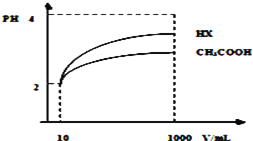
��4�����Ϊ10mLpH=2�Ĵ�����Һ��һԪ��HX�ֱ��ˮϡ����1000mL��ϡ����pH�仯��ͼ��ʾ����HX�ĵ���ƽ�ⳣ��____________��������������������������С�����������ƽ�ⳣ����ϡ�ͺ�HX��Һ��ˮ���������c��H+��______________������Һˮ�������c��H+����������������������������С��������
��5��25��ʱ��CH3COOH��CH3COONa�Ļ����Һ������û��ҺpH=6������Һ��c��CH3COO������c��Na+��=_________________����ȷ��ֵ����
����Ŀ���±�ΪԪ�����ڱ���һ���֣������Ԫ�آ٣����ڱ��е�λ�ã�����ѧ�����ش��������⣺
�� ���� | IA | 0 | ||||||
1 | �� | ��A | ��A | ��A | ��A | ��A | ��A | |
2 | �� | �� | �� | �� | ||||
3 | �� | �� | �� | �� | ||||
(1)ԭ�Ӱ뾶��С��Ԫ����____����Ԫ�����ƣ���д�����ԭ�ӽṹʾ��ͼ______��
(2)����������Ӧ��ˮ�����У�������ǿ����___���û�ѧʽ�ش���ͬ����������ǿ����___��
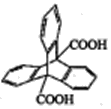
(3)������γɵĻ������У���ѧ������Ϊ_____��
(4)������γɵĻ�����ĵ���ʽΪ___��������γɵ�ԭ�Ӹ�����Ϊ1:2�Ļ�����ĽṹʽΪ____��
(5)�ۡ��ܡ���ԭ�Ӱ뾶�ɴ�С��˳��Ϊ_____����Ԫ�ط��Żش𣩡�
(6)Ϊ̽��Ԫ�آں͢�ķǽ�����ǿ����ijͬѧ�������ͼ��ʾ��װ�ý���ʵ�飨�г���������ȥ��װ�����������ã�����ش�
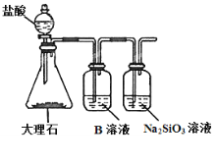
a.��ҺB��������_______
b.������____������֤������_______���û�ѧʽ�ش𣩣���ǽ�����_______����Ԫ�ط��Żش𣩡�
c.����ʵ���У���˵���ں͢�ǽ�����ǿ���Ļ�ѧ����ʽ��_____________��