题目内容
(2014届广东省江门市高三一模理综化学试卷)
从明矾[KAl(SO4)2·12H2O]制备Al、K2SO4和H2SO4的流程如下:
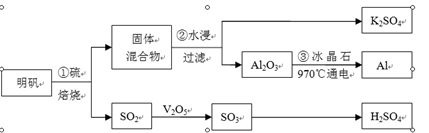
明矾焙烧的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4 +2Al2O3+9SO2↑+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,氧化剂是 。
(2)步骤②中,为提高浸出率,可采取的措施有 。
(3)从水浸后的滤液中得到K2SO4晶体的方法是 。
(4)步骤③电解的化学方程式是 ,电解池的电极是用碳素材料做成,电解过程中,阳极材料需要定期更换,原因是: 。
(5)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,则该电池的正极电极反应式是 。
(6)焙烧a吨明矾(摩尔质量为b g/mol),若SO2的转化率为96%,可生产质量分数为98%的H2SO4质量为 吨(列出计算表达式)。
从明矾[KAl(SO4)2·12H2O]制备Al、K2SO4和H2SO4的流程如下:

明矾焙烧的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4 +2Al2O3+9SO2↑+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,氧化剂是 。
(2)步骤②中,为提高浸出率,可采取的措施有 。
| A.粉碎固体混合物 | B.降低温度 | C.不断搅拌 | D.缩短浸泡时间 |
(4)步骤③电解的化学方程式是 ,电解池的电极是用碳素材料做成,电解过程中,阳极材料需要定期更换,原因是: 。
(5)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,则该电池的正极电极反应式是 。
(6)焙烧a吨明矾(摩尔质量为b g/mol),若SO2的转化率为96%,可生产质量分数为98%的H2SO4质量为 吨(列出计算表达式)。
(1)KAl(SO4)2·12H2O(2分)
(2) AC (2分,多选、错选0分)
(3)蒸发结晶(2分,“蒸发浓缩、冷却结晶”给1分)
(4)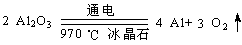 (2分)
(2分)
阳极中碳被氧化成CO2(CO) (2分,用化学方程式表示也可,如:
C+O2 CO2或2C+O2
CO2或2C+O2 2CO ,条件用加热或970℃也可)
2CO ,条件用加热或970℃也可)
(5)NiO(OH)+H2O+e-=Ni(OH)2+OH-(2分)
(6)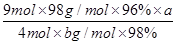 或
或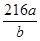 (3分,不带单位不扣分,化简也可以)
(3分,不带单位不扣分,化简也可以)
(2) AC (2分,多选、错选0分)
(3)蒸发结晶(2分,“蒸发浓缩、冷却结晶”给1分)
(4)
 (2分)
(2分)阳极中碳被氧化成CO2(CO) (2分,用化学方程式表示也可,如:
C+O2
 CO2或2C+O2
CO2或2C+O2 2CO ,条件用加热或970℃也可)
2CO ,条件用加热或970℃也可)(5)NiO(OH)+H2O+e-=Ni(OH)2+OH-(2分)
(6)
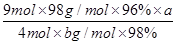 或
或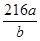 (3分,不带单位不扣分,化简也可以)
(3分,不带单位不扣分,化简也可以)(1)明矾的焙烧已经给出了方程式,因此本题主要是考查氧化还原反应的特征。该方程式中发生化合价变化的只有S元素,明矾中的S元素一部分发生化合价降低,而S单质的化合价升高,因此反应中的氧化剂是明矾(KAl(SO4)2·12H2O),还原剂是单质S。
(2)步骤②是水浸明矾焙烧后的固体混合物,因此要提高浸出率,往往需要增大接触面积、充分溶解;因此粉碎固体混合物、不断搅拌都是可行的。
(3)焙烧后的固体混合物是K2SO4和Al2O3,水浸后的溶液则是易溶于水的K2SO4溶液,所以要从单一组分的溶液中得到改溶质,可以直接蒸发结晶。
(4)氧化铝电解制备铝单质,该反应方程式为
 ;在电解反应中阴极还原得到单质铝,阳极得到O2,由于阳极电极材料是C单质,所以在高温环境下,碳素材料会被氧气氧化为CO或CO2,从而导致阳极碳素电极受损,要定期更换。
;在电解反应中阴极还原得到单质铝,阳极得到O2,由于阳极电极材料是C单质,所以在高温环境下,碳素材料会被氧气氧化为CO或CO2,从而导致阳极碳素电极受损,要定期更换。(5)以Al和NiO(OH)为电极构成的碱性电池,首先判断出单质Al做负极,NiO(OH)为正极;因此放电时正极得到电子被还原,从Ni的化合价变化可以得出得失电子数目,所以充分运用电荷守恒、原子守恒,再结合反应环境可以的该正极的反应式为NiO(OH)+H2O+e-=Ni(OH)2+OH-。
(6)计算思路:计算明矾物质的量,根据方程式计算SO2的总物质的量,根据S原子守恒H2SO4溶质的物质的量等于96%的SO2,把溶质H2SO4的物质的量转化为质量,再用溶质H2SO4的质量除以质量分数求得H2SO4溶液的总质量。计算列式为
 。
。
练习册系列答案
相关题目
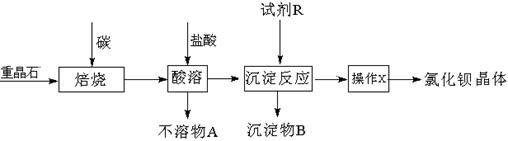

 +CaS+BaCl2。以下是从焙烧后的固体中分离得到氯化钡晶体的实验流程设计(已知硫化钙不溶于水,易溶于盐酸)。请在空格方框横线上填写操作名称。
+CaS+BaCl2。以下是从焙烧后的固体中分离得到氯化钡晶体的实验流程设计(已知硫化钙不溶于水,易溶于盐酸)。请在空格方框横线上填写操作名称。