题目内容
(2014届浙江省温州市十校联合体高三上学期期中联考化学试卷)
(15分)碱式碳酸铜的成分有多种,其化学式一般可表示为xCu(OH)2·yCuCO3。
(1)孔雀石呈绿色,是一种名贵的宝石,其主要成分是Cu(OH)2·CuCO3。某兴趣小组为探究制取孔雀石的最佳反应条件,设计了如下实验:
实验1:将2.0mL 0.50 mol·L–1的Cu(NO3)2溶液、2.0mL 0.50 mol·L–1的NaOH溶液和0.25 mol·L–1的Na2CO3溶液按表Ⅰ所示体积混合。
实验2:将合适比例的混合物在表Ⅱ所示温度下反应。
实验记录如下:
表Ⅰ 表Ⅱ
①实验室制取少许孔雀石,应该采用的最佳条件是 。
②80℃时,所制得的孔雀石有少量褐色物质的可能原因是 。
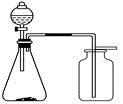
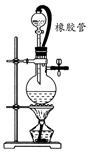
(2)实验小组为测定上述某条件下所制得的碱式碳酸铜样品组成,利用下图所示的装置(夹持仪器省略)进行实验:

步骤1:检查装置的气密性,将过滤、洗涤并干燥过的样品置于平直玻璃管中。
步骤2:打开活塞K,鼓入空气,一段时间后关闭,称量相关装置的质量。
步骤3:加热装置B直至装置C中无气泡产生。
步骤4: (请补充该步操作内容)。
步骤5:称量相关装置的质量。
①装置A的作用是 ;若无装置E,则实验测定的x/y的值将 。(选填“偏大”、“偏小”或“无影响”)。
②某同学在实验过程中采集了如下数据:
A.反应前玻璃管与样品的质量163.8g B.反应后玻璃管中残留固体质量56.0g
C.装置C实验后增重9.0g D.装置D实验后增重8.8g
为测定x/y的值,你认为可以选用上述所采集数据中的 (写出所有组合的字母代号)任一组即可进行计算,并根据你的计算结果,写出该样品组成的化学式 。
(15分)碱式碳酸铜的成分有多种,其化学式一般可表示为xCu(OH)2·yCuCO3。
(1)孔雀石呈绿色,是一种名贵的宝石,其主要成分是Cu(OH)2·CuCO3。某兴趣小组为探究制取孔雀石的最佳反应条件,设计了如下实验:
实验1:将2.0mL 0.50 mol·L–1的Cu(NO3)2溶液、2.0mL 0.50 mol·L–1的NaOH溶液和0.25 mol·L–1的Na2CO3溶液按表Ⅰ所示体积混合。
实验2:将合适比例的混合物在表Ⅱ所示温度下反应。
实验记录如下:
表Ⅰ 表Ⅱ
| 编号 | V (Na2CO3)/mL | 沉淀情况 | | 编号 | 反应温度/℃ | 沉淀情况 |
| 1 | 2.8 | 多、蓝色 | | 1 | 40 | 多、蓝色 |
| 2 | 2.4 | 多、蓝色 | | 2 | 60 | 少、浅绿色 |
| 3 | 2.0 | 较多、绿色 | | 3 | 75 | 较多、绿色 |
| 4 | 1.6 | 较少、绿色 | | 4 | 80 | 较多、绿色(少量褐色) |
①实验室制取少许孔雀石,应该采用的最佳条件是 。
②80℃时,所制得的孔雀石有少量褐色物质的可能原因是 。
(2)实验小组为测定上述某条件下所制得的碱式碳酸铜样品组成,利用下图所示的装置(夹持仪器省略)进行实验:

步骤1:检查装置的气密性,将过滤、洗涤并干燥过的样品置于平直玻璃管中。
步骤2:打开活塞K,鼓入空气,一段时间后关闭,称量相关装置的质量。
步骤3:加热装置B直至装置C中无气泡产生。
步骤4: (请补充该步操作内容)。
步骤5:称量相关装置的质量。
①装置A的作用是 ;若无装置E,则实验测定的x/y的值将 。(选填“偏大”、“偏小”或“无影响”)。
②某同学在实验过程中采集了如下数据:
A.反应前玻璃管与样品的质量163.8g B.反应后玻璃管中残留固体质量56.0g
C.装置C实验后增重9.0g D.装置D实验后增重8.8g
为测定x/y的值,你认为可以选用上述所采集数据中的 (写出所有组合的字母代号)任一组即可进行计算,并根据你的计算结果,写出该样品组成的化学式 。
(1) ①n[Cu(NO3)2]:n(NaOH) : n(Na2CO3)=2:2:1 75℃ ②有少量孔雀石受热分解为CuO
(2)打开活塞K,继续通一段时间空气 ①除去空气中的CO2和H2O 偏小
②BC、BD、CD(3分) 5Cu(OH)2·2CuCO3
(除倒数第二空3分外,其余每空2分,最佳条件缺一扣1分,答错不给分。共15分)
(2)打开活塞K,继续通一段时间空气 ①除去空气中的CO2和H2O 偏小
②BC、BD、CD(3分) 5Cu(OH)2·2CuCO3
(除倒数第二空3分外,其余每空2分,最佳条件缺一扣1分,答错不给分。共15分)
(1) ①由表中数据,0.25mol·L–1的Na2CO3溶液2mL时生成的碱式碳酸铜最多,此时n[Cu(NO3)2]:n(Na2CO3)=2:1;当温度在75℃,生成的碱式碳酸铜最佳。②温度较高,少量孔雀石受热分解生成CuO,孔雀石中含有的少量褐色物质是氧化铜。
(2)反应完毕后,需要继续通空气,让装置冷却。①装置A碱石灰是干燥剂,可吸收空气中的水蒸气和二氧化碳,防止对装置CD增重的数据造成影响,装置E的作用是防止空气中的二氧化碳和水蒸气进入D装置,D装置是吸收生成的二氧化碳的,C装置是吸收生成的水的,如果没有装置E,会使D装置质量增重偏大,即生成的二氧化碳质量偏大,则x/y的值会偏小。
②碱式碳酸铜分解的化学方程xCu(OH)2·yCuCO3
 (x+y)CuO + xH2O + yCO2↑
(x+y)CuO + xH2O + yCO2↑要测定
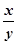 的值,可以测定生成的水和二氧化碳的质量,即测定C装置增重的质量和D装置增重的质量;故可选CD。
的值,可以测定生成的水和二氧化碳的质量,即测定C装置增重的质量和D装置增重的质量;故可选CD。xCu(OH)2·yCuCO3
 (x+y)CuO + xH2O + yCO2↑
(x+y)CuO + xH2O + yCO2↑18x 44y
9g 8.8g
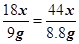
∴
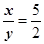
若测出反应后玻璃管中样品的质量以及装置C增重的质量,即已知生成的氧化铜和水的质量,可求出
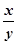 的值;故可选BC。
的值;故可选BC。xCu(OH)2·yCuCO3
 (x+y)CuO + xH2O + yCO2↑
(x+y)CuO + xH2O + yCO2↑(x+y)×80 18x
56g 9g
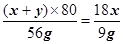
∴
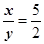
同样若已知反应后玻璃管中样品的质量以及装置D增重的质量,即已知生成的氧化铜和二氧化碳的质量,可求出出
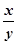 的值;故可选BD。
的值;故可选BD。xCu(OH)2·yCuCO3
 (x+y)CuO + xH2O + yCO2↑
(x+y)CuO + xH2O + yCO2↑(x+y)×80 44y
56g 8.8g

∴

练习册系列答案
 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目

 3Zn(OH)2 + 2Fe(OH)3 + 4KOH
3Zn(OH)2 + 2Fe(OH)3 + 4KOH