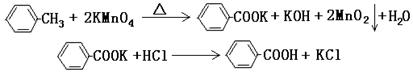
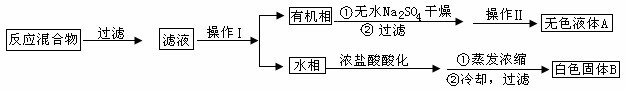
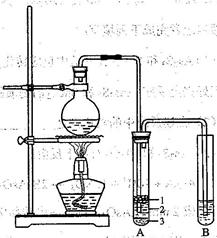
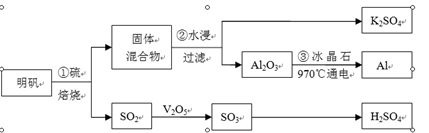
题目内容
下列有关实验装置进行的相应实验,能达到实验目的的是
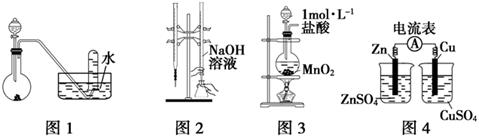

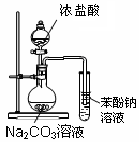
| A.用图1所示装置进行稀硝酸与铜的反应制取并收集NO |
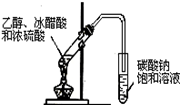
| B.用图2所示装置进行用已知浓度的氢氧化钠溶液测定盐酸浓度的实验 |
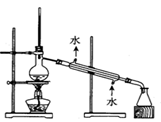
| C.用图3所示装置制取少量Cl2 |
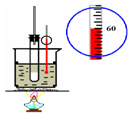
| D.用图4所示装置检验电流的方向 |
A
试题分析:A、稀硝酸与铜反应生成硝酸铜、NO和水,NO极易被空气中的氧气氧化,应该用排水法收集,A正确;B、氢氧化钠溶液应该用酸式滴定管盛放,B不正确;C、制备氯气应该用浓盐酸与二氧化锰反应,C不正确;D、没有形成闭合回路,不能形成原电池,D不正确,答案选A。

练习册系列答案
 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案
相关题目