题目内容
用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,反应如下:
3SiCl4 +2N2 +6H2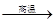 Si3N4 +12HCl
Si3N4 +12HCl
完成下列填空:
(1)氮化硅可用于制造发动机的耐热部件,因为它属于 晶体。有关氮化硅的上述反应中,原子最外层只有一个未成对电子的元素是 (填写元素符号);属于非极性分子的化合物的电子式是 。
(2)比较Si和Cl两种元素非金属性强弱的方法是 。
a.比较两种元素的气态氢化物的沸点
b.比较两种元素的原子获得一个电子时释放能量的大小
c.比较两种元素的原子达到稳定结构获得电子的多少
d.比较相同条件下两种元素氢化物水溶液的酸性强弱
(3)Si与Al、Be具有相似的化学性质,因为 (简述理由),写出Si与强碱溶液反应的离子反应方程式: 。
3SiCl4 +2N2 +6H2
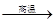 Si3N4 +12HCl
Si3N4 +12HCl完成下列填空:
(1)氮化硅可用于制造发动机的耐热部件,因为它属于 晶体。有关氮化硅的上述反应中,原子最外层只有一个未成对电子的元素是 (填写元素符号);属于非极性分子的化合物的电子式是 。
(2)比较Si和Cl两种元素非金属性强弱的方法是 。
a.比较两种元素的气态氢化物的沸点
b.比较两种元素的原子获得一个电子时释放能量的大小
c.比较两种元素的原子达到稳定结构获得电子的多少
d.比较相同条件下两种元素氢化物水溶液的酸性强弱
(3)Si与Al、Be具有相似的化学性质,因为 (简述理由),写出Si与强碱溶液反应的离子反应方程式: 。
(1)原子晶体 (1分) H、Cl(1分×2);
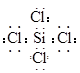 (1分)
(1分) (2)b (2分)
(3)它们都在元素周期表中金属和非金属的分界线附近(1分)
Si + 2OH- + H2O→SiO32- + 2H2↑(1分)
试题分析:(1)氮化硅制造发动机的耐热部件,熔点很高,属于原子晶体, H、N、Si、Cl的外围电子排布式分别为1s1、2s22p3、3s23p2、3s23p5、故H、Cl原子最外层只有一个未成对电子, SiCl4是非极性分子化合物,分子中Si原子与Cl原子之间形成1对共用电子对,电子式为
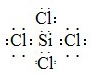 ,故答案为:原子;H、Cl;
,故答案为:原子;H、Cl;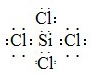 ;
;(2)a.气态氢化物的沸点为物理性质,不能说明非金属性强弱,故a错误; b.得到1个电子放出能量越多,表明该原子得到电子后越稳定,即越容易得到电子,非金属性越强,故b正确;非金属性越强,氢化物越稳定性,故氢化物稳定性可以说明中心元素的非金属性强弱,故正确; c.非金属性强弱与得电子多少无关,与得电子难易程度有关,如S原子得2个电子形成硫离子,Cl原子得1个电子形成硫离子,但硫元素非金属性强,故c错误; d.氢化物酸性强弱不能比较非金属性,若非金属性F>Cl,但HF是弱酸,HCl是强酸,故d错误;故答案为:b;
(3)Si与Al、Be都在元素周期表中金属和非金属的分界线附近,具有相似的化学性质; Si与强碱溶液反应生成硅酸盐与氢气,反应离子方程式为:Si+2OH-+H2O=SiO32-+2H2↑,故答案为:它们都在元素周期表中金属和非金属的分界线附近;Si+2OH-+H2O=SiO32-+2H2↑.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 Na2SiO3+CO2↑,说明酸性:H2SiO3>H2CO3
Na2SiO3+CO2↑,说明酸性:H2SiO3>H2CO3 CO(g)+H2(g) △H=+131.3kJ/mol,达到平衡后,体积不变时,能提高H2O的平衡转化率的措施是 。
CO(g)+H2(g) △H=+131.3kJ/mol,达到平衡后,体积不变时,能提高H2O的平衡转化率的措施是 。