题目内容
【题目】电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示。
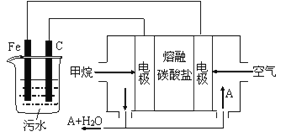
(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的__________。
a.H2SO4 b.BaSO4 c.Na2SO4 d.NaOH
(2)电解池阳极发生了两个电极反应,电极反应式分别是
Ⅰ.___________________; Ⅱ._________________;
(3)电极反应Ⅰ和Ⅱ的生成物反应得到Fe(OH)3沉淀的离子方程式是__________________;
(4)该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料做电极。
①负极的电极反应是____________________;
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见上图)。A物质的化学式是_________________;
(5)实验过程中,若在阴极产生了44.8 L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况)____L。
【答案】C Fe-2e-=Fe2+ 4OH--4e-=2H2O+O2↑ 4Fe2++10H2O+O2=4Fe(OH)3↓+8H+ CH4-8e-+4CO32 -=5CO2 +2H2O CO2 11.2 L
【解析】
(1)从所加入物质能增大溶液离子的浓度,并能保持污水的pH在5.0~6.0之间进行分析;
(2)根据阳极电极材料和离子的放电顺序分析放电的离子,书写电极反应;
(3)二价铁离子具有还原性,能被氧气氧化为三价;
(4)①燃料电池中,负极上燃料失电子发生氧化反应;
②根据两极上发生的反应确定循环使用的物质;
(5)在燃料电池和电解池的串联电路中,转移的电子数目是相同的。
(1)为了增强溶液的导电性,可选用易溶的强电解质溶液,排除B项,考虑到污水的pH在5.0~6.0之间,因此不能使用氢氧化钠,硫酸能将Fe(OH)3溶解,因此应向污水中加入适量的硫酸钠;
(2)电解时,铁作阳极,失电子,发生反应Fe-2e-=Fe2+,同时溶液中的OH-失电子被氧化为O2,因此,电极反应为:Ⅰ.Fe-2e-=Fe2+,Ⅱ. 4OH--4e-=2H2O+O2↑;
(3)Fe2+具有还原性,能被氧气氧化为三价,那么得到Fe(OH)3沉淀的离子方程式为:4Fe2++10H2O+O2=4Fe(OH)3↓+8H+;
(4)①燃料电池中,负极上燃料失电子发生氧化反应,电极反应为:CH4-8e-+4CO32 -=5CO2 +2H2O;
②由电极反应可知电池工作时参加循环的物质为CO2;
(5)阴极的电极反应为2H++2e-=H2↑,阴极产生了44.8 L(即2mol)气体,转移的电子的物质的量为4mol,由CH4-8e-+4CO32-=5CO2 +2H2O可知,当转移的电子的物质的量为4mol时,消耗CH4的体积为V=nVm=![]() ×4mol×22.4L/mol=11.2L。
×4mol×22.4L/mol=11.2L。

 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案【题目】甲苯(![]() )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛(![]() )、苯甲酸(
)、苯甲酸(![]() )等产品。表列出了有关物质的部分物理性质,请回答:
)等产品。表列出了有关物质的部分物理性质,请回答:
名称 | 性状 | 熔点(℃) | 沸点(℃) | 相对密度 (ρ水=1g/cm3) | 溶解性 | |
水 | 乙醇 | |||||
甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8660 | 不溶 | 互溶 |
苯甲醛 | 无色液体 | -26 | 179 | 1.0440 | 微溶 | 互溶 |
苯甲酸 | 白色片状或针状晶体 | 122.1 | 249 | 1.2659 | 微溶 | 易溶 |
注:甲苯、苯甲醛、苯甲酸三者互溶。
实验室可用如图装置模拟制备苯甲醛。实验时先在三颈瓶中加入0.5g固态难溶性催化剂,再加入15mL冰醋酸(作为溶剂)和2mL甲苯,搅拌升温至70℃,同时缓慢加入12mL过氧化氢,在此温度下搅拌反应3小时。
 (1)装置a的名称是______________。
(1)装置a的名称是______________。
(2)三颈瓶中发生反应的化学方程式为_______________________________________。
(3)经测定,反应温度升高时,甲苯的转化率逐渐增大,但温度过高时,苯甲醛的产量却有所减少,可能的原因是_____________________________________________。
(4)反应完毕后,反应混合液经过自然冷却至室温时,还应经过_____、_____(填操作名称)等操作,才能得到苯甲醛粗产品。
(5)实验中加入过量过氧化氢且反应时间较长,会使苯甲醛产品中产生较多的苯甲酸。
①若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的操作步骤是_______(按步骤顺序填字母)。
a.对混合液进行分液 b.过滤、洗涤、干燥
c.水层中加入盐酸调节pH=2 d.加入适量碳酸氢钠溶液混合振荡
②若对实验①中获得的苯甲酸产品进行纯度测定,可称取2.500g产品,溶于200mL乙醇配成溶液,量取所得的乙醇溶液20.00mL于锥形瓶,滴加2~3滴酚酞指示剂,然后用预先配好的0.1000mol/L KOH标准液滴定,到达滴定终点时消耗KOH溶液18.00mL。产品中苯甲酸的质量分数为_____。(苯甲酸相对分子质量:122.0)
【题目】下列说法是否正确
(1) | (2) | (3) | (4) |
___ | ___ | ___ | ___ |
(1)22.4LO2中一定含有6.02×1023个氧分子
(2)将80gNaOH溶于1L水中,所得溶液中NaOH的物质的量浓度为2mol/L
(3)18gH2O在标准状况下的体积是22.4L
(4)在标准状况时,20mLNH3与60mLO2所含的分子个数比为1:3


