题目内容
【题目】铜元素是一种金属化学元素,也是人体所必须的一种微量元素, 铜也是人类最早发现的金属,是人类广泛使用的一种金属,属于重金属。
(1)写出基态铜原子的价层电子排布式_________________。
(2)简单金属离子在水溶液中的颜色大多与价层电子中含有的未成对电子数有关,如Fe3+呈黄色,Fe2+呈绿色,Cu2+呈蓝色等。预测Cu+为_____色,解释原因________________。
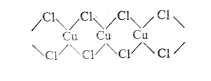
(3)X射线研究证明,CuCl2的结构为链状,如图所示,它含有的化学键类型为_________,在它的水溶液中加入过量氨水,得到 [Cu(NH3)4]Cl2溶液, [Cu(NH3)4]Cl2中H-N-H的夹角_________(填“大于”、“等于”或“小于”)NH3分子中的H-N-H的夹角,原因是___________。
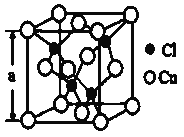
(4)某种铜的氯化物晶体结构如图:此晶体中铜原子的配位数是__________,若氯原子位于铜形成的四面体的体心,且铜原子与铜原子、铜原子与氯原子都是采取最密堆积方式,则氯原子与铜原子半径之比为__________________。
【答案】3d104s1 无 Cu+中无单电子 共价键、配位键 大于 [Cu(NH3)4]Cl2 中氮原子无孤电子对,NH3 中氮原子有孤电子对,孤电子对对成键电子排斥力大,键角小 4 ![]()
【解析】
(1)铜是29号元素,核外电子排布式为1s22s22p63s23p63d104s1,价层电子排布式3d104s1,故答案为:3d104s1;
(2) 根据价层电子排布,Fe3+有5对未成对电子,呈黄色;Fe2+有4对未成对电子,呈绿色,可知Cu+无颜色,因为Cu+中无单电子,故答案为:无;Cu+中无单电子;
(3)根据氯化铜的结构可知分子中含有的化学键类型为共价键、配位键;NH3中N原子含有3个共价键和1个孤电子对,由于NH3提供孤对电子与Cu2+ 形成配位键后,N-H成键电子对受到的排斥力减小,所以H-N-H键角增大或NH3分子内存在孤电子对,孤电子对与共用电子对之间的斥力更大,所以NH3的键角更小,故答案为:共价键、配位键;大于; [Cu(NH3)4]Cl2 中氮原子无孤电子对,NH3 中氮原子有孤电子对,孤电子对对成键电子排斥力大,键角小;
(4)晶胞中Cl原子数目为4,晶胞中Cu原子数目为8×![]() +6×
+6×![]() =4,二者原子数目为1∶1,故配位数也相等,Cu原子与周围4个Cl原子形成正四面体,Cu的配位数为4;若C1原子位于Cu原子构成的四面体体心,则体对角线是铜原子和氯原子的半径之和的4倍,Cu原子位于立方体的顶点和面心,为面心立方最密堆积,则面对角线是铜原子半径的4倍,设晶胞的边长为a cm,面对角线等于
=4,二者原子数目为1∶1,故配位数也相等,Cu原子与周围4个Cl原子形成正四面体,Cu的配位数为4;若C1原子位于Cu原子构成的四面体体心,则体对角线是铜原子和氯原子的半径之和的4倍,Cu原子位于立方体的顶点和面心,为面心立方最密堆积,则面对角线是铜原子半径的4倍,设晶胞的边长为a cm,面对角线等于![]() ,则铜原子半径为
,则铜原子半径为![]() ,体对角线等于
,体对角线等于![]() ,则氯原子半径为
,则氯原子半径为![]() ,则氯原子与铜原子半径之比等于
,则氯原子与铜原子半径之比等于![]() ,故答案为:4;
,故答案为:4;![]() 。
。

【题目】二甲醚被称为“21世纪的清洁燃料”。利用甲醇脱水可制得二甲醚。反应方程式如下:2CH3OH(g)≒CH3OCH3(g)+H2O(g) ΔH1
(1) 二甲醚亦可通过合成气反应制得,相关热化学方程式如下:2H2(g)+CO(g)≒CH3OH(g) ΔH2
CO(g)+H2O(g)≒CO2(g)+H2(g) ΔH3 3H2(g)+3CO(g)≒CH3OCH3(g) +CO2(g) ΔH4
则ΔH1=__________________(用含有ΔH2、ΔH3、ΔH4的关系式表示).
(2)经查阅资料,上述甲醇脱水反应平衡常数Kp的计算式为lnKp= - 2.205+(2708.6137/T) (Kp为以分压表示的平衡常数,T为热力学温度),且催化剂吸附H2O(g)的量会受压强影响,从而进步影响催化效率。
①在一定温度范围内,随温度升高,CH3OH(g)脱水转化为CH3OCH3(g)的倾向__________ (填“增大”、“不变”或“减小”),ΔH4________2ΔH2+ΔH3 (填“>”、<”或“=”)。
物质 | CH3OH | CH3OCH3 | H2O |
分压/MPa | 0.50 | 0.50 | 0.50 |
②某温度下(此时Kp=100),在密闭容器中加入一定量CH3OH,某时刻测得各组分的压如下:
此时正、逆反应速率的大小:V正____V逆(填“>”、“<”或“=”)。
③200℃时,在密闭容器中加入一定量CH3OH,反应到达平衡状态时,体系中CH3OCH3(g)的物质的量分数为__________(填序号).
A.< 1/3 B.1/3 C.1/3~1/2 D.1/2 E.> 1/2
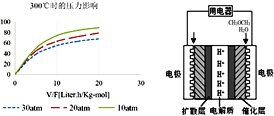
④300℃时,使CH3OH(g)以一定流速通过催化剂,V/F(按原料流率的催化剂量)、压强对甲醇转化率影响如图1所示。请简述在上述条件下,压强对甲醇转化率影响的规律,并解释变化原因__________。
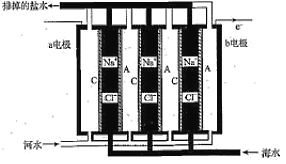
(3)直接二甲醚燃料电池有望大规模商业化应用,工作原理如图2所示。
①负极的电极反应式为__________。
②现利用该电池电解CuC12溶液,当消耗2.3g二甲醚时,电解所得铜的质量为_________g(设电池的能量利用率为50%)。
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 实验结论 |
A | 向20%蔗糖溶液中加入少量稀H2SO4,加热;再加入银氨溶液,水浴加热后未出现银镜 | 蔗糖未水解 |
B | 卤代烃Y与NaOH乙醇溶液共热后,加入足量稀硝酸,再滴加AgNO3溶液,产生白色沉淀 | 说明卤代烃Y中含有氯原子 |
C | 向浑浊的苯酚试液中加饱和Na2CO3溶液,试液变澄清且无气体产生 | 说明苯酚的酸性强于碳酸 |
D | 向鸡蛋清溶液中加入少量CuSO4溶液,出现浑浊 | 蛋白质发生了盐析 |
A. A B. B C. C D. D
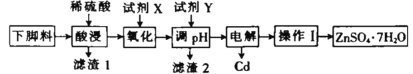
【题目】ZnSO47H2O可用于测定钢铁及炉渣的含硫量。某工厂下脚料中含锌、镉(Cd)、铜、铁等金属,以该下脚料为原料制备ZnSO47H2O并回收Cu、Cd的工艺流程如图所示:
已知部分氢氧化物开始及完全沉淀的pH如表所示(起始时金属离子浓度按0.1molL-1计算):
氢氧化物 | Fe(OH)3 | Cd(OH)2 | Zn(OH)2 |
开始沉淀的 pH | 1.9 | 7.4 | 6.2 |
完全沉淀的 pH | 3.2 | 9.5 | 8.2 |
请回答下列问题:
(1)滤渣1中含有_______(填化学式)。
(2)试剂X是双氧水时,写岀氧化过程中发生反应的离子方程式_______。
(3)pH的调控范围是_______,试剂Y可选用_______(填字母)
A. NaOH B. ZnO C. ZnCO3
(4)电解时以汞(Hg)作电极可以将镉与锌完全分离,镉单质在_______(填“阴”或“阳”)极析出,阳极的电极反应式为_______。
(5)操作I包括的操作是_______及过滤等,过滤后得到的滤液可以加入_______ (填“酸浸”或“氧化”)步骤循环利用。