题目内容
【题目】二甲醚被称为“21世纪的清洁燃料”。利用甲醇脱水可制得二甲醚。反应方程式如下:2CH3OH(g)≒CH3OCH3(g)+H2O(g) ΔH1
(1) 二甲醚亦可通过合成气反应制得,相关热化学方程式如下:2H2(g)+CO(g)≒CH3OH(g) ΔH2
CO(g)+H2O(g)≒CO2(g)+H2(g) ΔH3 3H2(g)+3CO(g)≒CH3OCH3(g) +CO2(g) ΔH4
则ΔH1=__________________(用含有ΔH2、ΔH3、ΔH4的关系式表示).
(2)经查阅资料,上述甲醇脱水反应平衡常数Kp的计算式为lnKp= - 2.205+(2708.6137/T) (Kp为以分压表示的平衡常数,T为热力学温度),且催化剂吸附H2O(g)的量会受压强影响,从而进步影响催化效率。
①在一定温度范围内,随温度升高,CH3OH(g)脱水转化为CH3OCH3(g)的倾向__________ (填“增大”、“不变”或“减小”),ΔH4________2ΔH2+ΔH3 (填“>”、<”或“=”)。
物质 | CH3OH | CH3OCH3 | H2O |
分压/MPa | 0.50 | 0.50 | 0.50 |
②某温度下(此时Kp=100),在密闭容器中加入一定量CH3OH,某时刻测得各组分的压如下:
此时正、逆反应速率的大小:V正____V逆(填“>”、“<”或“=”)。
③200℃时,在密闭容器中加入一定量CH3OH,反应到达平衡状态时,体系中CH3OCH3(g)的物质的量分数为__________(填序号).
A.< 1/3 B.1/3 C.1/3~1/2 D.1/2 E.> 1/2
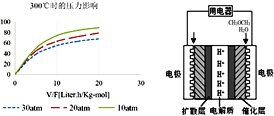
④300℃时,使CH3OH(g)以一定流速通过催化剂,V/F(按原料流率的催化剂量)、压强对甲醇转化率影响如图1所示。请简述在上述条件下,压强对甲醇转化率影响的规律,并解释变化原因__________。
(3)直接二甲醚燃料电池有望大规模商业化应用,工作原理如图2所示。
①负极的电极反应式为__________。
②现利用该电池电解CuC12溶液,当消耗2.3g二甲醚时,电解所得铜的质量为_________g(设电池的能量利用率为50%)。
【答案】ΔH 4-2ΔH2 -ΔH 3 减小 < > C 规律:其他条件不变时,随压强(压力)增大,甲醇转化率降低,原因:压强增大,催化剂吸附水分子的量增多,催化效率降低,相同时间里转化量减少,甲醇转化率降低。 (说明:如规律写错,解释不给分) CH3OCH3—12e-+3H2O=2CO2+12H+ 9.6
【解析】
(1)根据盖斯定律计算;
(2)①lnKp= - 2.205+(2708.6137/T),升高温度lnKp减小,则Kp减小,平衡逆向移动;
②Qp与Kp的关系判断;
③根据lnKp= - 2.205+(2708.6137/T),计算Kp,若催化剂对水蒸气无影响时和催化剂对水蒸气有影响计算P(CH3OCH3)及 CH3OCH3(g)的物质的量分数;
④根据图像可知,温度相同时,随压强的增大,甲醇转化率降低,压强增大,催化剂吸附H2O(g)的量会受压强影响;
(3)①二甲醚燃料电池中,二甲醚失电子,化合价升高,作电池的负极,电解质溶液显酸性,则生成二氧化碳和氢离子;
②根据转移电子数目守恒计算。
(1)①2H2(g)+CO(g)CH3OH(g) ΔH2 ②CO(g)+H2O(g) CO2(g)+H2(g) ΔH3 ③3H2(g)+3CO(g) CH3OCH3(g) +CO2(g) ΔH4,根据盖斯定律,③-②-2①,可得2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH1=ΔH4-2ΔH2 -ΔH 3;
(2)①lnKp= - 2.205+(2708.6137/T),升高温度lnKp减小,则Kp减小,平衡逆向移动,转化成CH3OCH3(g)的倾向减小;ΔH1<0,则ΔH4<2ΔH2 -ΔH 3;
②Qp= ![]() =
=![]() =1<100,平衡正向进行,则V正>V逆;
=1<100,平衡正向进行,则V正>V逆;
③若初始投入的甲醇完全反应时,生成等量的二甲醚和水,二甲醚占据的物质的量分数为![]() ;lnKp= - 2.205+(2708.6137/T),温度为200℃时,Kp=33.78,若催化剂对水蒸气无影响时,且P(CH3OH)=1,则P(CH3OCH3)=5.8,压强之比等于物质的量之比,CH3OCH3(g)的物质的量分数为
;lnKp= - 2.205+(2708.6137/T),温度为200℃时,Kp=33.78,若催化剂对水蒸气无影响时,且P(CH3OH)=1,则P(CH3OCH3)=5.8,压强之比等于物质的量之比,CH3OCH3(g)的物质的量分数为![]() =0.46,答案为C;
=0.46,答案为C;
④根据图像可知,温度相同时,随压强的增大,甲醇转化率降低,压强增大,催化剂吸附H2O(g)的量会受压强影响,导致催化剂吸附水分子的量增多,催化效率降低,相同时间里转化量减少,甲醇转化率降低。
(3)①二甲醚燃料电池中,二甲醚失电子,化合价升高,作电池的负极,电解质溶液显酸性,则生成二氧化碳和氢离子,电极反应式为CH3OCH3-12e-+3H2O=2CO2+12H+;
②消耗2.3g二甲醚时,转移电子的物质的量为0.05×12=0.6mol,铜离子得电子生成单质铜,生成![]() =0.15molCu,即9.6g。
=0.15molCu,即9.6g。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案