题目内容
【题目】(1)元素M的离子与NH4+所含电子数和质子数均相同,则M的原子结构示意图为________。
(2)硫酸铝溶液与过量氨水反应的离子方程式为_______________________________。
(3)能证明Na2SO3溶液中存在SO32-+H2OHSO3-+OH-水解平衡的事实是________(填序号)。
A.滴入酚酞溶液变红,再加入H2SO4溶液后红色褪去
B.滴入酚酞溶液变红,再加入氯水后红色褪去
C.滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去
(4)某学生用中和滴定法测定某NaOH溶液的物质的量浓度,选酚酞作指示剂。盛装0.2000 mol/L盐酸标准液应该用______________式滴定管;用盐酸滴定待测液NaOH,滴定终点时的颜色变化是_____________且30s不变色。
【答案】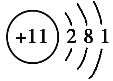 3NH3·H2O+Al3+===Al(OH)3↓+3NH4+ C 酸 浅红色变为无色
3NH3·H2O+Al3+===Al(OH)3↓+3NH4+ C 酸 浅红色变为无色
【解析】
(1)NH4+所含电子数是10、质子数是11;
(2)硫酸铝溶液与过量氨水反应生成氢氧化铝沉淀和硫酸铵;
(3)如果亚硫酸钠不水解,则溶液中氢氧根离子和氢离子浓度相等,溶液呈中性,向溶液中加入酚酞后溶液不变色,加入和亚硫酸根离子反应的物质后,溶液红色褪色,则证明存在水解平衡;
(4)酸性溶液盛装在酸式滴定管中;氢氧化钠使酚酞呈红色,滴加盐酸过程中溶液碱性减弱;
(1)NH4+所含电子数是10、质子数是11,所以元素M是Na,原子结构示意图为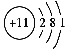 ;
;
(2)硫酸铝溶液与过量氨水反应生成氢氧化铝沉淀和硫酸铵;反应的离子方程式为3NH3·H2O+Al3+==Al(OH)3↓+3NH4+;
(3)A、滴入酚酞试液变红,说明亚硫酸钠溶液中氢氧根离子浓度大于氢离子浓度,溶液呈碱性,加入硫酸溶液后,硫酸中和氢氧根离子,溶液褪色,不能说明水解平衡移动,故不选A;
B、滴入酚酞试液变红,说明溶液中氢氧根离子浓度大于氢离子浓度,氯水具有强氧化性,具有漂白性,加入氯水后溶液褪色,不能说明存在水解平衡移动,故不选B;
C、滴入酚酞试液变红,说明溶液中氢氧根离子浓度大于氢离子浓度,再加入氯化钡溶液后,钡离子和亚硫酸根离子反应而和氢氧根离子不反应,钡离子和亚硫酸根离子反应生成亚硫酸钡沉淀,且溶液红色褪去,说明存在水解平衡移动,故选C;
(4)酸性溶液盛装在酸式滴定管中,盛装0.2000 mol/L盐酸标准液应该用酸式滴定管;氢氧化钠使酚酞呈红色,滴加氨水过程中溶液碱性减弱,所以用盐酸滴定待测液NaOH,滴定终点时的颜色变化是浅红色变为无色且30s不变色。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案