题目内容
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)请设计简单实验检验绿矾是否氧化变质。限选试剂:蒸馏水,KSCN溶液,氯水,KMnO4溶液,铁粉________________________________________________ 。实验室保存绿矾水溶液时为防其氧化要加入 ______ 。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。

①仪器B的名称是____________________。
②将下列实验操作步骤补充完整d-___ ___-f-___ ___(填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=________________(列式表示)。若实验时按a、d次序操作,则使x__________(填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。

①C、D中的溶液依次为_________(填标号)。C、D中有气泡冒出,并可观察到的现象分别为____,______。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式_____________________________。
【答案】取少量绿矾晶体于试管中,加蒸馏水溶解,再向其中加入KSCN溶液,若不变红色,则未变质。 铁粉 干燥管 a b c e 76(m2-m3)/[9(m3-m1)] 偏小 c、a 生成白色沉淀 褪色 2FeSO4![]() Fe2O3+SO2
Fe2O3+SO2![]() +SO3
+SO3![]()
【解析】
(1) Fe2+氧化变质为Fe3+;单质铁可以把Fe3+还原为Fe2+;
(2) ① 根据装置图分析仪器名称;
②实验时,为避免亚铁被氧化,应先通入氮气,冷却时注意关闭开关,防止氧气进入,冷却至室温再称量固体质量的变化;
③直至A恒重,记为m3 g,应为FeSO4和装置的质量,则m(FeSO4)=(m3-m1);m(H2O)=(m2-m3),以此计算n(H2O)、n(FeSO4),结晶水的数目等于![]() ;若实验时按a、d次序操作,会导致硫酸亚铁被氧化;
;若实验时按a、d次序操作,会导致硫酸亚铁被氧化;
(3)硫酸亚铁高温分解可生成Fe2O3、SO3、SO2,C为氯化钡,用于检验SO3,D为品红,可用于检验SO2;
(1) Fe2+氧化变质为Fe3+,Fe3+的检验方法是:取少量绿矾晶体于试管中,加蒸馏水溶解,再向其中加入KSCN溶液,若不变红色,则未变质。单质铁可以把Fe3+还原为Fe2+,实验室保存绿矾水溶液时为防其氧化要加入铁粉;
(2) ① 根据装置图,仪器B的名称是干燥管;
②实验时,为避免亚铁被氧化,应先通入氮气,冷却时注意关闭开关,防止氧气进入,冷却至室温再称量固体质量的变化,则正确的顺序为dabfce;
③直至A恒重,记为m3 g,应为FeSO4和装置的质量,则m(FeSO4)=(m3-m1),m(H2O)=(m2-m3),则n(H2O)=![]() 、n(FeSO4)=
、n(FeSO4)=![]() ,结晶水的数目等于=
,结晶水的数目等于=![]() :
:![]() = 76(m2-m3)/[9(m3-m1)]; 若实验时按a、d次序操作,会导致硫酸亚铁被氧化,则导致固体质量偏大,测定结果偏小;
= 76(m2-m3)/[9(m3-m1)]; 若实验时按a、d次序操作,会导致硫酸亚铁被氧化,则导致固体质量偏大,测定结果偏小;
(3)①实验后反应管中残留固体为红色粉末,说明生成Fe2O3,则反应中Fe元素化合价升高,S元素化合价应降低,则一定生成SO2,可知硫酸亚铁高温分解可生成Fe2O3、SO3、SO2,C中为氯化钡,用于检验SO3,可观察到产生白色沉淀,D中为品红,可用于检验SO2,品红褪色;
②硫酸亚铁高温分解可生成Fe2O3、SO3、SO2,根据得失电子守恒配平方程式为2FeSO4![]() Fe2O3+SO2↑+SO3↑。
Fe2O3+SO2↑+SO3↑。

【题目】化学变化中伴随着能量的转化,在理论研究和生产生活中有很重要的作用。
Ⅰ.催化剂是化工技术的核心,绝大多数的化工生产均需采用催化工艺。

(1)人们常用催化剂来选择反应进行的方向.图1所示为一定条件下1 mol CH3OH 与O2发生反应时.生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去]。在有催化剂作用下,CH3OH与O2反应主要生成________(填“CO”、“CO2”或“HCHO”);2HCHO(g)+O2(g)=2CO(g)+2H2O(g) △H=________。
Ⅱ.第三代混合动力车,可以用电动机,内燃机或二者结合推动车辆。汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在刹车或下坡时,电池处于充电状态。
(2)混合动力车的内燃机以汽油为燃料,汽油(以辛烷C8H18计)和氧气充分反应,生成1 mol 水蒸气放热550kJ;若1 g水蒸气转化为液态水放热2.5kJ,则辛烷燃烧热的热化学方程式为_____________。

(3)混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液。镍氢电池充放电原理示意如图,其总反应式为: H2+2NiOOH![]() 2Ni(OH)2。
2Ni(OH)2。
根据所给信息判断,混合动力车上坡或加速时.乙电极周围溶液的pH______(填“增大”,“减小”或“不变”),该电极的电极反应式为_______________。
(4)远洋轮船的钢铁船体在海水中易发生电化学有腐蚀中的______腐蚀。为防止这种腐蚀,通常把船体与浸在海水里的Zn块相连,或与像铅酸蓄电池这样的直流电源的______(填“正”或“负”)极相连。
Ⅲ.A、B、C三种强电解质,它们在水中电离出的离子如表所示:
阳离子 | Ag+ Na+ |
阴离子 | NO3- SO42 - Cl- |
如图1所示的装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、C三种溶液。电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加了27克。常温下各烧杯中溶液的pH与电解时间t的关系图如图2所示。据此回答下列问题:
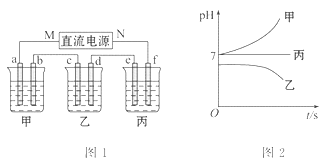
(5)M为电源的______极(填写“正”或“负”),甲为__________(填写化学式)。
(6)计算电极f上生成的气体在标准状况下的体积_________。
(7)写出乙烧杯中的电解池反应______________________。
(8)若电解后甲溶液的体积为25 L,则该溶液的pH为_______。
(9)要使丙恢复到原来的状态,应加入_______g______。(填写化学式)
