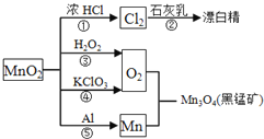
题目内容
【题目】称取(NH4)2SO4和NH4HSO4混合物样品11.2g,加入含0.1 molNaOH的溶液,完全反应,生成NH3 1344 mL(标准状况),则(NH4)2SO4和NH4HSO4的物质的量比为( )
A. 1:1B. 1:2C. 1.25:1D. 1.8:1
【答案】C
【解析】
(NH4)2SO4和NH4HSO4混合物样品中加入NaOH溶液,NH4HSO4电离出的氢离子优先反应,剩余的NaOH与铵根离子反应生成氨气。
(NH4)2SO4和NH4HSO4混合物样品中加入NaOH溶液,NH4HSO4电离出的氢离子优先反应,标准状况下1344 mL 氨气的物质的量为:![]() 0.06mol,根据NH4+~OH-可知与氢离子反应消耗NaOH的物质的量为:0.1mol-0.06mol=0.04mol,则NH4HSO4的物质的量为0.04mol,所以(NH4)2SO4的质量为:11.2g -115g/mol×0.04mol=6.6g,其物质的量为
0.06mol,根据NH4+~OH-可知与氢离子反应消耗NaOH的物质的量为:0.1mol-0.06mol=0.04mol,则NH4HSO4的物质的量为0.04mol,所以(NH4)2SO4的质量为:11.2g -115g/mol×0.04mol=6.6g,其物质的量为![]() 0.05mol,(NH4)2SO4和NH4HSO4的物质的量比为0.05:0.04=1.25:1,故选C。
0.05mol,(NH4)2SO4和NH4HSO4的物质的量比为0.05:0.04=1.25:1,故选C。

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目
【题目】如何除去下列物质中的杂质,请在相关栏目内填表
含杂质物质 | 除杂试剂或方法 | 有关反应的化学方程式 |
(1)NO(NO2 ) | ______ | ______ |
(2)SiO2(CaCO3) | ______ | ______ |
(3)SO2 (HCl ) | ______ | ______ |
(4)Na2CO3固体(NaHCO3) | ______ | ______ |