题目内容
12.常温下,稀释0.1mol•L-1CH3COONa溶液,如图中的纵坐标可以表示( )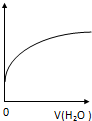
| A. | CH3COO-水解常数 | B. | 溶液中CH3COOH的数目 | ||
| C. | 溶液的PH | D. | 溶液中CH3COO- 的浓度 |
分析 A、水解的平衡常数只与温度有关;
B、稀释过程中水解平衡CH3COO-+H2O?CH3COOH+OH-向右移动;
C、加水稀释,溶液的体积增大,溶液中氢氧根离子浓度减小;
D、稀释过程中水解平衡CH3COO-+H2O?CH3COOH+OH-向右移动,所以CH3COOH的数目增大,溶液中CH3COO- 的浓度减小.
解答 解:A、水解的平衡常数只与温度有关,加水稀释平衡常数不变,故A错误;
B、稀释过程中水解平衡CH3COO-+H2O?CH3COOH+OH-向右移动,所以CH3COOH的数目增大,故B正确;
C、加水稀释,溶液的体积增大,溶液中氢氧根离子浓度减小,所以稀释过程中溶液pH应逐渐减小,故C错误;
D、稀释过程中水解平衡CH3COO-+H2O?CH3COOH+OH-向右移动,所以CH3COOH的数目增大,溶液中CH3COO- 的浓度减小,故D错误;
故选B.
点评 本题考查了盐类水解的方向应用,主要是平衡常数、平衡影响因素,溶液稀释过程中离子浓度的变化分析判断是解题关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.下列有关有机化学的说法中不正确的是( )
| A. | 按系统命名法,化合物CH3CH(CH3)CH(CH3)CH2CH3名称2,3-二甲基戊烷 | |
| B. | 用新制的Cu(OH)2悬浊液可以鉴别乙酸、乙醇和葡萄糖 | |
| C. | 有机物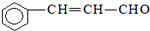 可发生加成反应、氧化反应、还原反应和聚合反应 可发生加成反应、氧化反应、还原反应和聚合反应 | |
| D. | 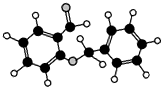 如图所示的有机物分子式为C14H12O2,不能发生银镜反应 |
3.下列对三种有机物的叙述不正确的是( )
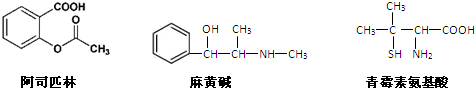

| A. | 青霉素氨基酸不能与盐酸反应,但能与NaOH溶液反应 | |
| B. | 阿司匹林能与NaOH溶液反应生成可溶性有机物 | |
| C. | 麻黄碱的分子式是C10H15NO,苯环上的一氯代物有3种 | |
| D. | 三种有机物都能发生酯化反应 |
4.下列化学用语的表述不正确的是( )
| A. | 过氧化氢的结构式:H-O-O-H | B. | 氮原子的L层电子轨道表示式: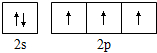 | ||
| C. | CO2的比例模型: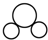 | D. | Cl-的结构示意图: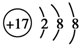 |
2.下列说法一定不正确的是( )
| A. | 某些花岗石产生氡(${\;}_{86}^{222}$Rn),从而对人体产生伤害,${\;}_{86}^{222}$Rn的质量数是222 | |
| B. | Se是人体必需的微量元素,${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se互为同位素,是两种不同的核素 | |
| C. | ${\;}_{92}^{235}$U的浓缩一直被国际社会关注,其中子数和质子数之差为51 | |
| D. | 113号元素属于过渡元素 |
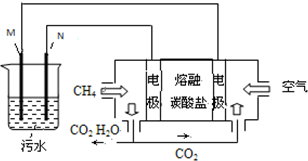 工业废水中常含有一定量的Cr2O72-,会对人类及生态系统产生很大损害,电解法是一种行之有效的除去铬的方法之一.该法用Fe和石墨作电极电解含Cr2O72-的酸性废水,最终将铬转化为Cr(OH)3沉淀,达到净化目的.某科研小组利用以上方法处理污水,设计了熔融盐电池和污水电解装置如图所示.
工业废水中常含有一定量的Cr2O72-,会对人类及生态系统产生很大损害,电解法是一种行之有效的除去铬的方法之一.该法用Fe和石墨作电极电解含Cr2O72-的酸性废水,最终将铬转化为Cr(OH)3沉淀,达到净化目的.某科研小组利用以上方法处理污水,设计了熔融盐电池和污水电解装置如图所示.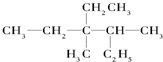 用系统命名法命名:3,4-二甲基-3-乙基己烷
用系统命名法命名:3,4-二甲基-3-乙基己烷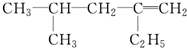
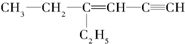 ,分子中饱和碳原子数为4个,可能在同一平面上的碳原子数最多为8个
,分子中饱和碳原子数为4个,可能在同一平面上的碳原子数最多为8个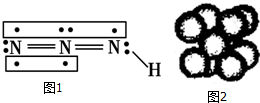 叠氮化物是一类重要化合物,氢叠氮酸(HN3)是一种弱酸,如图为分子结构示意图1.肼(N2H4)被亚硝酸氧化时便可生成氢叠氮酸(HN3):N2H4+HNO2═2H2O+HN3.它的酸性类似于醋酸,可微弱电离出H+和N3-.
叠氮化物是一类重要化合物,氢叠氮酸(HN3)是一种弱酸,如图为分子结构示意图1.肼(N2H4)被亚硝酸氧化时便可生成氢叠氮酸(HN3):N2H4+HNO2═2H2O+HN3.它的酸性类似于醋酸,可微弱电离出H+和N3-. .
.