题目内容
3.下列对三种有机物的叙述不正确的是( )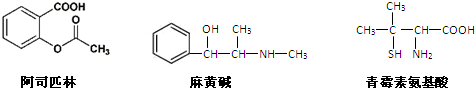
| A. | 青霉素氨基酸不能与盐酸反应,但能与NaOH溶液反应 | |
| B. | 阿司匹林能与NaOH溶液反应生成可溶性有机物 | |
| C. | 麻黄碱的分子式是C10H15NO,苯环上的一氯代物有3种 | |
| D. | 三种有机物都能发生酯化反应 |
分析 A.青霉素氨基酸中含有羧基和强碱,具有酸碱性;
B.阿司匹林中含有羧基和酯基,和氢氧化钠的水溶液发生反应生成钠盐;
C.麻黄碱的分子式是C10H15NO,苯环上有几种氢原子就能几种一氯代物;
D.含有羧基或羟基的物质能发生酯化反应.
解答 解:A.青霉素氨基酸中含有羧基和强碱,具有酸碱性,所以能和盐酸、NaOH溶液反应,故A错误;
B.阿司匹林中含有羧基和酯基,和氢氧化钠的水溶液发生水解反应,水解生成的醇羟基、羧基能和氢氧化钠发生中和反应,最终都生成钠盐,钠盐是可溶性盐,故B正确;
C.麻黄碱的分子式是C10H15NO,苯环上有3种氢原子所以其一氯代物是3种,故C正确;
D.含有羧基或羟基的物质能发生酯化反应,阿司匹林和青霉素氨基酸中含有羧基、麻黄碱中含有醛基,所以都能发生酯化反应生成酯,故D正确;
故选A.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系即可解答,侧重考查酯、醇、羧酸及氨基酸的性质,注意氨基酸具有两性,易错选项是B.

练习册系列答案
相关题目
6.下列说法正确的是( )
| A. | CH2═CH2和CH3CH2C1都属于烃 | B. | 乙烯和乙烷都能发生加聚反应 | ||
| C. | 米酒变酸的过程涉及氧化反应 | D. | 未成熟的苹果遇碘水不会变蓝 |
7.下列溶液中微粒的物质的量浓度关系正确的是( )
| A. | 氯水中:c(Cl2)=2c(ClO-)+2c(Cl-)+2c(HClO) | |
| B. | Na2CO3溶液:c(OH-)=c(HCO3-)+2c(H2CO3)+c(H+) | |
| C. | 等浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3) | |
| D. | 室温下,向0.01 mol•L-1 NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
11.地球外层空间存在着微量的臭氧(O3)和氧原子.该臭氧层的存在能吸收和阻挡太阳的有害的强烈紫外辐射.可是人为的大气污染物会破坏臭氧层,如超音速飞机排放物中的氮氧化物(NO和NO2),它们和O3、O发生下列反应:O3+NO═NO2+O2;O+NO2═NO+O2,这两个反应反复循环,由此可见在反应中氮氧化物是( )
| A. | 氧化剂 | B. | 还原剂 | C. | 催化剂 | D. | 反应物 |
15.有关说法中正确的是( )
| A. | 分子中键能越大,键长越长,则分子越稳定 | |
| B. | P4和CH4都是正四面体型结构的分子,且键角都为109°28ˊ | |
| C. | 在化学反应中,某元素由化合态变为游离态,则该元素一定被还原 | |
| D. | 电子层结构相同的简单离子,其半径随核电荷数增大而减小 |
12.常温下,稀释0.1mol•L-1CH3COONa溶液,如图中的纵坐标可以表示( )
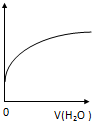

| A. | CH3COO-水解常数 | B. | 溶液中CH3COOH的数目 | ||
| C. | 溶液的PH | D. | 溶液中CH3COO- 的浓度 |
13.已知反应KClO3+6HCl=KCl+3Cl2↑+3H2O,若用K35ClO3和H37Cl反应,则下列说法正确的是( )
| A. | 该反应中电子转移数为6 | B. | 生成的氯气式量约为73.3 | ||
| C. | KCl中既有35Cl,又有37Cl | D. | KCl中只含35Cl |
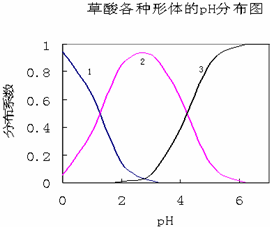 草酸(H2C2O4)是一种易溶于水的二元中强酸,在水中它的存在形态有H2C2O4、HC2O4-、C2O42-,各形态的分布系数(浓度分数)α随溶液pH变化的关系如图所示:
草酸(H2C2O4)是一种易溶于水的二元中强酸,在水中它的存在形态有H2C2O4、HC2O4-、C2O42-,各形态的分布系数(浓度分数)α随溶液pH变化的关系如图所示: 名称:邻二甲苯或1,2-二甲基苯
名称:邻二甲苯或1,2-二甲基苯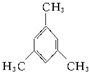 名称:1,3,5-三甲基苯.
名称:1,3,5-三甲基苯.