题目内容
15.下列有关有机化学的说法中不正确的是( )| A. | 按系统命名法,化合物CH3CH(CH3)CH(CH3)CH2CH3名称2,3-二甲基戊烷 | |
| B. | 用新制的Cu(OH)2悬浊液可以鉴别乙酸、乙醇和葡萄糖 | |
| C. | 有机物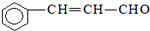 可发生加成反应、氧化反应、还原反应和聚合反应 可发生加成反应、氧化反应、还原反应和聚合反应 | |
| D. | 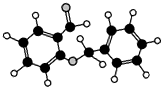 如图所示的有机物分子式为C14H12O2,不能发生银镜反应 |
分析 A.CH3CH(CH3)CH(CH3)CH2CH3主链为5个C原子,含有2个甲基;
B.乙酸具有酸性,葡萄糖含有醛基,结合官能团的性质判断;
C.含有碳碳双键,可发生加成、加聚和氧化反应,含有醛基,可发生氧化、还原反应;
D.由结构模型可知含有醛基,可发生银镜反应.
解答 解:A.CH3CH(CH3)CH(CH3)CH2CH3主链为5个C原子,含有2个甲基,名称2,3-二甲基戊烷,故A正确;
B.乙酸具有酸性,葡萄糖含有醛基,加入氢氧化铜浊液,乙酸可使浊液澄清,乙醇无现象,加热条件下葡萄糖与氢氧化铜发生氧化还原反应生成砖红色沉淀,可鉴别,故B正确;
C.含有碳碳双键,可发生加成、加聚和氧化反应,含有醛基,可发生氧化、还原反应,故C正确;
D.由结构模型可知含有醛基,可发生银镜反应,故D错误.
故选D.
点评 本题综合考查有机物的结构和性质,为高考常见题型,侧重于学生的分析能力的考查,注意把握有机物的命名、鉴别以及官能团的性质,难度不大,注意反应类型的判断.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.某研究性学习小组向一定童的NaHSO3溶液(加入少量淀粉)中加人稍过量的KIO3溶液,一段时间后.溶液突然变蓝色.为进一步研究有关因素对该反应速率的影响,探究如下.
(1)查阅资料知NaHSO3与过量KIO3反应分为两步进行,且其反应速率主要由笫一步反应决定.已知第一步反应的离子方程式为IO3-+3HSO3-=3SO42-+I-+3H+,则第二步反应的离子方程式为IO3-+5I-+6H+=3I2+3H2O.
(2)通过测定溶液变蓝所用时间来探究外界条件对该反应速率的影响,记录如下.
实验①②是探究KIO3溶液的浓度对反应速率的影响,表中t1>t2 (填“>”、“=”或“<“);
实验①③是探究温度对反应速率的影响,表中a=10.0 b=4.0
(3)将NaHSO3溶液与KIO3溶液在恒温条件下混合,用速率检测仪检测出起始阶段反应速率逐渐增大.该小组对其原因提出如下假设,请你完成假设二.
假设一:生成的SO42-对反应起催化作用;
假设二:反应生成的I-对反应起催化作用(或反应生成的H+对反应起催化作用).
(4)请你设计实验验证上述悝设一,完成下表中内容.
(1)查阅资料知NaHSO3与过量KIO3反应分为两步进行,且其反应速率主要由笫一步反应决定.已知第一步反应的离子方程式为IO3-+3HSO3-=3SO42-+I-+3H+,则第二步反应的离子方程式为IO3-+5I-+6H+=3I2+3H2O.
(2)通过测定溶液变蓝所用时间来探究外界条件对该反应速率的影响,记录如下.
| 编号 | 0.01mol/L NaHSO3溶液/mL | 0.01mol/L KIO3 溶液/mL | H2O/mL | 反应温度/ ℃ | 溶液变蓝所用 时间t/s |
| ① | 6.0 | 10.0 | 4.0 | 15 | t1 |
| ② | 6.0 | 14.0 | 0 | 15 | t2 |
| ③ | 6.0 | a | b | 25 | t3 |
实验①③是探究温度对反应速率的影响,表中a=10.0 b=4.0
(3)将NaHSO3溶液与KIO3溶液在恒温条件下混合,用速率检测仪检测出起始阶段反应速率逐渐增大.该小组对其原因提出如下假设,请你完成假设二.
假设一:生成的SO42-对反应起催化作用;
假设二:反应生成的I-对反应起催化作用(或反应生成的H+对反应起催化作用).
(4)请你设计实验验证上述悝设一,完成下表中内容.
| 实验步職(不要求写出具体搡作过程) | 预期实验现象和结论 |
| 在烧杯甲中将一定量的NaHSO3溶液与KIO3溶液混合,用速率检测仪测定起始时的反应速率v(甲); 在烧杯乙中预先加入少量Na2SO4粉末,其他条件与甲完全相同,进行同一反应, 用速率检测仪测定其起始阶段相同时间内的反应速率v(乙). | 若v(甲)=v(乙) 则假设一不成立 若v(甲)<v(乙),则假设一成立 |
6.下列说法正确的是( )
| A. | CH2═CH2和CH3CH2C1都属于烃 | B. | 乙烯和乙烷都能发生加聚反应 | ||
| C. | 米酒变酸的过程涉及氧化反应 | D. | 未成熟的苹果遇碘水不会变蓝 |
10.下述实验设计合理的( )
| 选项 | 实验目的 | 实验设计 |
| A | 检测溶液中是否含有Fe2+ | 向溶液中滴入氯水后,再滴加KSCN溶液 |
| B | 除去CO2中的HCl | 通过饱和的NaHCO3溶液,然后干燥 |
| C | 除去乙酸乙酯中的乙酸 | 加入足量的NaOH溶液,然后分液 |
| D | 证明H2CO3酸性比H2SiO3强 | Na2CO3和SiO2在高温下熔融反应 |
| A. | A | B. | B | C. | C | D. | D |
7.下列溶液中微粒的物质的量浓度关系正确的是( )
| A. | 氯水中:c(Cl2)=2c(ClO-)+2c(Cl-)+2c(HClO) | |
| B. | Na2CO3溶液:c(OH-)=c(HCO3-)+2c(H2CO3)+c(H+) | |
| C. | 等浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3) | |
| D. | 室温下,向0.01 mol•L-1 NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
11.地球外层空间存在着微量的臭氧(O3)和氧原子.该臭氧层的存在能吸收和阻挡太阳的有害的强烈紫外辐射.可是人为的大气污染物会破坏臭氧层,如超音速飞机排放物中的氮氧化物(NO和NO2),它们和O3、O发生下列反应:O3+NO═NO2+O2;O+NO2═NO+O2,这两个反应反复循环,由此可见在反应中氮氧化物是( )
| A. | 氧化剂 | B. | 还原剂 | C. | 催化剂 | D. | 反应物 |
12.常温下,稀释0.1mol•L-1CH3COONa溶液,如图中的纵坐标可以表示( )
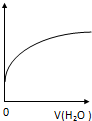

| A. | CH3COO-水解常数 | B. | 溶液中CH3COOH的数目 | ||
| C. | 溶液的PH | D. | 溶液中CH3COO- 的浓度 |
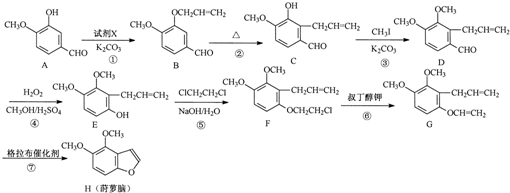
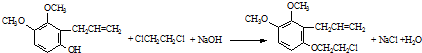 .
.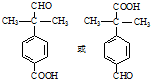 .
.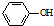 为原料制备
为原料制备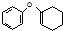 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3 .
.