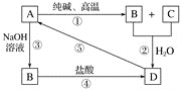
题目内容
【题目】用如图所表示的方法研究金属钠与水反应的性质,其中A是用带孔的铝箔包着的小块的金属钠.
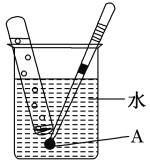
(1)从大块钠上取下的小块钠要用滤纸擦一擦,这样做的目的是_______________。
(2)包裹钠块的铝箔要预先扎上足够多的小孔,若孔数不够,可能出现的不良后果是__________.假如在实验刚开始就将镊子松开拿出水面,A表现出的现象是 _______________________,出现这种现象的原因是______________。
(3)据预测,钠与水反应生成氢气和氢氧化钠.
证明生成氢氧化钠的实验方法和相应的现象是______________________;
(4)已知反应结束后铝箔和钠均消失,请写出相关反应的离子方程式:______________________________
【答案】擦去钠表面上的煤油,避免影响实验效果 发生爆炸 钠浮在水面上 钠的密度小于水,且生成的氢气,增大了A所受的浮力 向烧杯内的溶液中滴入3滴酚酞,溶液变红色 2Na+2H2O=2OH-+H2↑、2Al+2OH-+2H2O=3H2↑+2AlO2-
【解析】
(1)根据实验室中一般将金属钠保存在煤油中分析;
(2)根据钠与水剧烈反应生成氢氧化钠、氢气,并放出大量的热分析;根据金属钠的密度小于水的密度分析;
(3)氢氧化钠是碱,遇酚酞变红色;
(4)钠与水反应生成氢气和氢氧化钠,铝能与氢氧化钠反应,据此解答。
(1)为了防止金属钠被氧气、水所氧化,实验室中一般将金属钠保存在煤油中,在使用金属钠时,为了不影响实验效果,一般要用滤纸擦净其表面上的煤油;
(2)包裹钠块的铝箔要预先扎上足够多的小孔,若孔数不够,可能出现的不良后果是发生爆炸,其原因是:金属钠具有很强的还原性,常温下钠与水剧烈反应生成氢氧化钠、氢气,并放出大量的热,故在封闭的空间内易发生爆炸。假如在实验刚开始就将镊子松开拿出水面,由于金属钠的密度小于水的密度,铝箔的密度也比较小,而且钠与水反应生成的氢气更增大了A所受的浮力,故包有钠的铝箔会浮出水面;
(3)氢氧化钠是碱,遇酚酞变红色,故证明生成氢氧化钠的实验方法和相应的现象为:向烧杯内的溶液中滴入3滴酚酞,溶液变红色;
(4)钠与水反应生成氢气和氢氧化钠,离子方程式为2Na+2H2O=2OH-+H2↑;生成的氢氧化钠能溶解金属铝,反应的离子方程式为2Al+2OH-+2H2O=3H2↑+2AlO2-。