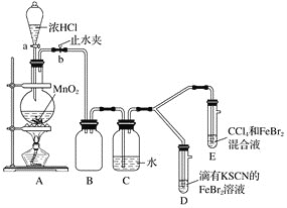
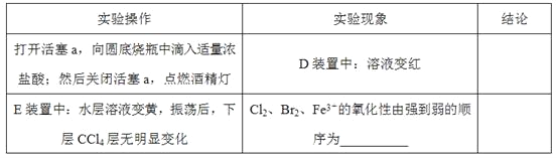
题目内容
【题目】钇钡铜氧(YBa2Cu3O7-x)类高温超导材料(其中Y显+3价,Cu显+2、+3价)可由Y2(CO3)3、BaCO3和CuCO3混合在高温下反应制得。回答下列问题:
(1)Y(钇)是一种稀土金属元素,与Sc(钪)同族相邻。X在元素周期表中的位置是_______,目前的周期表中,该族共有______种元素。
(2)基态Cu3+的电子排布式为________。铜有CuO和Cu2O两种氧化物,后者比前者热稳定性强,原因是____________________________________。
(3) CO32-中C原子釆取_______杂化;第一电离能:C_____O(填“>”或“<”)。
(4)某种钇钡铜氧材料中x=0.2,则n(Cu3+):n(Cu2+)=________。
(5)如图是另一种钇钡铜氧超导材料的晶胞结构示意图,其化学式为______,晶体中Y3+的坐标是______;若其摩尓质量为Mg·mol-1,阿伏加徳罗常数的值为NA,则该晶体的密度为____g·cm-3。

【答案】 第5周期IIIB族 32 [Ar]3d8 Cu2O中Cu+的3d能级为全充满状态,较稳定 sp2 < 1:4 YBa2Cu3O7 (0,0,0) M/a2bNA
【解析】(1)Sc是第21号元素,处于周期表的第4周期IIIB族,所以Y在第5周期IIIB族。该族中包括Sc、Y、镧系(15个元素)、锕系(15个元素)一共32种元素。
(2)Cu为第29号元素,基态排布为[Ar]3d104s1,所以Cu3+应该失去3个电子变为:[Ar]3d8。铜有CuO和Cu2O两种氧化物,后者比前者热稳定性强,原因是Cu2O中Cu为+1价,失去最外层的1个电子,变为[Ar]3d10的结构,此时3d能级达到全满的稳定结构,所以Cu2O的稳定性较强。
(3)根据价层电子对互斥理论,CO32-的中心碳原子的价电子对为3+(4-2×3+2)/2=3对,配位数为3,所以离子为平面三角形结构,碳原子的杂化类型为sp2杂化。同周期从左向右第一电离能逐渐增大,所以第一电离能:C<O。
(4)某种钇钡铜氧材料中x=0.2,则化学式为:YBa2Cu3O6.8,设其中Cu3+和Cu2+分别有X和Y个,所以有X+Y=3;再根据化合价代数之和为0,得到3+2×2+3X+2Y=2×6.8;解得:X=0.6,Y=2.4;所以n(Cu3+):n(Cu2+)=1:4。
(5)Y有8个在顶点,所以Y有:8×1/8=1个;Ba有8个在棱边上,所以Ba有8×1/4=2个; Cu都在晶胞内部有3个;O有2个在晶胞内,另外10个都在晶胞的面上,所以O有:2+10×1/2=7个;由上晶体的化学式为:YBa2Cu3O7。Y位于晶胞的顶点,所以其坐标为(0,0,0)。若其摩尓质量为Mg·mol-1,阿伏加徳罗常数的值为NA,则晶胞的质量为M/NA g,晶胞的体积为a2b cm3,所以晶胞的密度为:M/a2bNA g·cm-3。

【题目】某小组研究溶液中Fe2+与NO2-、NO3-的反应。
实验I | 试剂 | 现象 | |
滴管 | 试管 | ||
2mL | 1 mol·L-1FeSO4溶液(pH=4) | 1 mol·L-1 NaNO2溶液(pH=8) | a.滴入1滴FeSO4溶液,溶液变黄色,继续滴加,溶液变为棕色。2小时后,无明显变化 |
1 mol·L-1NaNO3溶液(加NaOH溶液至pH=8) | b.持续滴加FeSO4溶液,无明显变化。 | ||
资料:[Fe(NO)]2+在溶液中呈棕色。[Fe(NO)]2+![]() Fe2++NO。
Fe2++NO。
(1)研究现象a中的黄色溶液。
①用______溶液(填试剂名称)检出溶液中含有Fe3+。
②甲认为是O2氧化了溶液中的Fe2+。乙认为O2不是主要原因,理由是________________________。
③进行实验Ⅱ,装置如图。证实了Fe2+被NO2-氧化为Fe3+。装置左侧烧杯中的试剂为:______________,实验过程中右侧电极上产生无色气泡,电极反应式为_____________________,左侧烧杯中的现象为:_____________________。
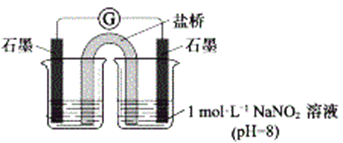
(2)研究现象a中的棕色溶液。
①综合实验Ⅰ和实验Ⅱ,提出假设:现象a中溶液变为棕色可能是NO与溶液中的Fe2+或Fe3+发生了反应。进行实验Ⅲ,证实溶液呈棕色只是因为Fe2+与NO发生了反应。实验Ⅲ的操作和现象是____________________________________________。
②加热实验Ⅰ中的棕色溶液,有气体逸出,该气体在接近试管口处变为红棕色,溶液中有红褐色沉淀生成。解释产生红褐色沉淀的原因是________________________________________。
(3)研究酸性条件下,溶液中Fe2+与NO2-、NO3-的反应。
序号 | 操作 | 现象 |
ⅰ | 取1 mol·L-1的NaNO2溶液,加醋酸至pH=3,加入1 mol·L-1FeSO4溶液 | 溶液立即变为棕色 |
ⅱ | 取1 mol·L-1的NaNO3溶液,加醋酸至pH=3,加入1 mol·L-1FeSO4溶液 | 无明显变化 |
ⅲ | 分别取0.5 mL 1 mol·L-1的NaNO3溶液与1 mol·L-1的FeSO4溶液,混合,小心加入0.5 mL浓硫酸 | 液体分为两层,稍后,在两层液体界面上出现棕色环 |
①ⅰ中溶液变为棕色的离子方程式是____________________________、Fe2++NO =[Fe(NO)]2+。
②ⅲ中出现棕色的原因是________________________________。
实验结论:本实验条件下,溶液中NO2、NO3的氧化性与溶液的酸碱性等有关。