题目内容
19.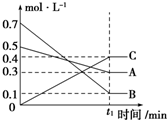 (1)T℃时,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图所示,根据图示可知:A与B反应生成C的化学方程式为A(g)+3B(g)?2C(g).
(1)T℃时,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图所示,根据图示可知:A与B反应生成C的化学方程式为A(g)+3B(g)?2C(g).(2)在80℃时,将0.40mol 的N2O4气体充入2L 已经抽空的固定容积的密闭容器中,发生如下反应:N2O4?2NO2,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间/s n/mol | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
分析 (1)由图(Ⅰ)可知,A和B的物质的量浓度减小,C的物质的量浓度增加,则A、B为反应物,C为生成物,由反应的浓度的变化之比等于化学计量数之比判断反应的化学方程式;
(2)先根据二氧化氮物质的量计算20s内反应的四氧化二氮的物质的量,进而计算20s时容器内四氧化二氮的物质的量,再计算20s~40s参加反应的四氧化二氮的物质的量,再根据速率定义式计算四氧化二氮的平均反应速率.
解答 解:(1)由图(Ⅰ)可知,A和B的物质的量浓度减小,C的物质的量浓度增加,则A、B为反应物,C为生成物,由反应的浓度的变化之比等于化学计量数之比可得:△c(A):△c(B):△c(C)=0.2mol/L:0.6mol/L:0.4mol/L=1:3:2,则反应的化学方程式为:A(g)+3B(g)?2C(g),
故答案为:A(g)+3B(g)?2C(g);
(2)20s时△n(NO2)=0.24mol,故△n(N2O4)=$\frac{1}{2}$△n(NO2)=$\frac{1}{2}$×0.24mol=0.12mol,所以a=0.4mol-0.12mol=0.28mol,故20s~40s参加反应的四氧化二氮的物质的量为0.28mol-0.2mol=0.08mol,所以20s-40s内用N2O4表示的平均反应速率为$\frac{\frac{0.08mol}{2L}}{20s}$=0.002mol/(L•s),
故答案为:0.002mol/(L•s).
点评 本题考查化学平衡图象问题以及化学反应速率计算,题目难度中等,解答该题时注意分析图象的曲线变化特点,由图象得出反应的化学方程式为解答该题的关键.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
15.在乙醇发生的各种反应中,断键方式不正确的是( )
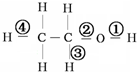

| A. | 与钠反应① | B. | 在铜催化下加热①③ | ||
| C. | 在浓硫酸170°C条件下加热②③ | D. | 与HCl反应生成氯乙烷② |
16.CO2和CH4是两种重要的温室气体,通过化学反应可以将它们转化为其他物质.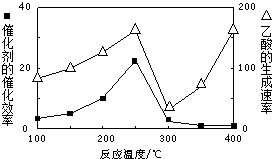
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H1=-802.0kJ•mol-1
CO(g)+H2O(g)=CO2(g)+H2(g)△H2=-41.2kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H3=-566.0kJ•mol-1
反应CO2(g)+CH4(g)=2CO(g)+2H2(g)的△H=+247.6kJ•mol-1.
(2)在一定条件下,CH4和CO2以镍合金为催化剂,发生反应:CO2(g)+CH4(g)?2CO(g)+2H2(g),其平衡常数与温度的关系如下表:
①该反应的平衡常数表达式为K=$\frac{{c}^{2}(CO){c}^{2}({H}_{2})}{c(C{O}_{2})c(C{H}_{4})}$.
②k1、K2的关系是K1<K2.(填写“>”、“<”或“=”)
(3)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸.
①催化剂的催化效率与乙酸的生成速率随温度的变化关系如图所示.250~300℃时,温度升高而乙酸的生成速率降低的原因是温度超过250℃时,催化剂的催化效率降低.
②为了提高该反应中CH4的转化率,可以采取的措施是增大反应压强、增大CO2的浓度.
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O.
(4)以氢氧化钾水溶液作电解质进行电解,CO2在铜电极上可转化为甲烷,该电极反应式为CO2+8e-+6H2O=CH4+8OH-.

(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H1=-802.0kJ•mol-1
CO(g)+H2O(g)=CO2(g)+H2(g)△H2=-41.2kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H3=-566.0kJ•mol-1
反应CO2(g)+CH4(g)=2CO(g)+2H2(g)的△H=+247.6kJ•mol-1.
(2)在一定条件下,CH4和CO2以镍合金为催化剂,发生反应:CO2(g)+CH4(g)?2CO(g)+2H2(g),其平衡常数与温度的关系如下表:
| 温度/℃ | 200℃ | 250℃ | 300℃ |
| 平衡常数/(mol•L-1)2 | K1 | K2 | 80 |
②k1、K2的关系是K1<K2.(填写“>”、“<”或“=”)
(3)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸.
①催化剂的催化效率与乙酸的生成速率随温度的变化关系如图所示.250~300℃时,温度升高而乙酸的生成速率降低的原因是温度超过250℃时,催化剂的催化效率降低.
②为了提高该反应中CH4的转化率,可以采取的措施是增大反应压强、增大CO2的浓度.
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O.
(4)以氢氧化钾水溶液作电解质进行电解,CO2在铜电极上可转化为甲烷,该电极反应式为CO2+8e-+6H2O=CH4+8OH-.
8.下列各组给定原子序数的元素,不能形成原子个数之比为1:1共价化合物的是( )
| A. | 3和17 | B. | 1和8 | C. | 6和8 | D. | 7和12 |

 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O. 与
与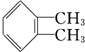
 与
与
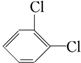 与
与
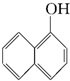 与
与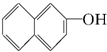


 +nH2O.
+nH2O.