题目内容
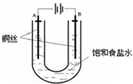 已知:Kap(CuCl,白色)=1.2×10-6,Kap(CuOH,橙黄色)=1.2×10-14.如图,用铜电极电解饱和食盐水时,阳极发生的电极反应为Cu-e-+Cl-=CuCl.下列说法不正确的是( )
已知:Kap(CuCl,白色)=1.2×10-6,Kap(CuOH,橙黄色)=1.2×10-14.如图,用铜电极电解饱和食盐水时,阳极发生的电极反应为Cu-e-+Cl-=CuCl.下列说法不正确的是( )| A、B极发生的电极反应为2H++2e-=H2↑ |
| B、实验开始时,A极附近出现白色浑浊 |
| C、电解时,Na+移向A极 |
| D、一段时间后,U形管底部形成橙黄色沉淀 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:用铜电极电解饱和食盐水时,阳极发生氧化反应,电极反应为Cu-e-+Cl-=CuCl,阴极发生还原反应,电极方程式为2H++2e-=H2↑,开始时生成CuCl白色生成,随着反应进行,溶液pH逐渐增大,因Kap(CuOH)<Kap(CuCl),则可生成CuOH橙黄色沉淀,结合离子的定向移动解答该题.
解答:
解:A.B为阴极,发生还原反应,电极方程式为2H++2e-=H2↑,故A正确;
B.铜为阳极,发生氧化反应,电极反应为Cu-e-+Cl-=CuCl,可观察到A极附近出现白色浑浊,故B正确;
C.电解时,阳离子向阴极移动,即移向B极,故C错误;
D.因Kap(CuOH)<Kap(CuCl),则可生成CuOH橙黄色沉淀,故D正确.
故选C.
B.铜为阳极,发生氧化反应,电极反应为Cu-e-+Cl-=CuCl,可观察到A极附近出现白色浑浊,故B正确;
C.电解时,阳离子向阴极移动,即移向B极,故C错误;
D.因Kap(CuOH)<Kap(CuCl),则可生成CuOH橙黄色沉淀,故D正确.
故选C.
点评:本题考查电解原理,为高频考点,侧重于学生的分析能力的考查,注意把握题给信息,正确书写电极方程式为解答该题的关键,注意审题,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
向两份a mL b mol/L的稀盐酸中分别加入x mL的水和y mL b mol/L Ba(OH)2溶液,此时两溶液的pH恰好相等,则x、y的关系符合(式中a、b均大于零,设两溶液混合时的体积有加和性)( )
| A、y=2ax+b | ||||
B、y=
| ||||
C、
| ||||
D、x=
|
已知还原性Cl-<Fe2+<I-<SO2,则下列反应不能发生的是( )
| A、2Fe2++I2═2Fe3++2I- |
| B、I2+SO2+2H2O═H2SO4+2HI |
| C、2Fe3++2I-═2Fe2++I2 |
| D、Cl2+2Fe2+═2Fe3++2Cl- |
研究表明,SO2水溶液中存在着如下所示多个平衡,向该溶液中( )
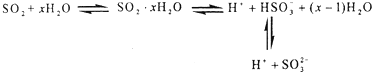
| A、滴加石蕊试液,先变红后褪色 |
| B、滴加品红溶液,先褪色后变红 |
| C、通入硫化氢气体,溶液pH先升高后降低 |
| D、加入足量氯化钡溶液,有白色沉淀生成 |
标况下,在五个烧瓶中分别充入①纯净的氨气②混有
空气的HCl③纯净的NO2④NO2与O2体积比4:1⑤NO与O2体积比4:3.然后做喷泉实验.实验后,三烧瓶中溶液的物质的量浓度大小关系是( )
| 1 |
| 5 |
| A、①=②=③=④=⑤ |
| B、①=②=③>④>⑤ |
| C、①=②=③>⑤>④ |
| D、①>③>②>⑤>④ |
下列关于SO2性质的分析,正确的是( )
| A、通入BaCl2溶液中,有白色沉淀生成 |
| B、通入FeCl3溶液中,有SO42-生成 |
| C、通入氯水中,有淡黄色沉淀生成 |
| D、通入KI溶液中,有I2生成 |
下列实验不能达到预期目的是( )
| A、用饱和NaHCO3溶液除去CO2中少量的HCl |
| B、用醋和澄清石灰水验证蛋壳中含有碳酸盐 |
| C、在试管中煮沸液体时,加碎石片可防止暴沸 |
| D、用硝酸酸化的氯化钡溶液检验某溶液中是否含有SO42- |
已知二氯化二硫(S2Cl2)的结构式为Cl-S-S-Cl,它易与水反应2S2Cl2+2H2O→4HCl+SO2↑+3S↓.在该反应中( )
| A、S2Cl2既作氧化剂又作还原剂 |
| B、氧化产物与还原产物物质的量比为3:1 |
| C、每生成22.4L SO2转移3mol电子 |
| D、每生成48g硫会断裂6mol共价键 |
下列方法能用于鉴别二甲醚(CH3OCH3)和乙醇的是( )
| A、李比希燃烧法 |
| B、铜丝燃烧法 |
| C、红外光谱法 |
| D、元素分析仪 |