题目内容
【题目】某溶液中可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
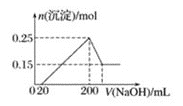
、![]() 等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的质量随加入的NaOH的物质的量的变化如图所示:
等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的质量随加入的NaOH的物质的量的变化如图所示:

(1)由此可知,该溶液中肯定含有的离子是______________________________________,且各离子的物质的量之比为___________________________________________
(2)该溶液中肯定不含的阳离子是________________。
(3)写出NaOH的物质的量从8mol到9mol发生的离子反应方程式:____________________________
【答案】![]() 、
、![]() 、
、![]() 、
、![]()
![]()
![]() 、
、![]()
![]()
【解析】
从图中沉淀量随之氢氧化钠的加入量增加变化情况结合离子的性质可知:开始发生酸碱中和,然后Al3+与碱反应,再NH4+与碱反应,最后沉淀与碱反应完全溶解,依据各段发生反应消耗的氢氧化钠的物质的量计算各种离子的物质的量。
(1)从图象可知,开始时无沉淀产生,说明含有H+,发生反应:H++OH-=H2O,该氢离子消耗NaOH溶液的物质的量为2mol,则n(H+)=2mol;图象中有一段平台,说明加入OH-时无沉淀生成,有NH4+,NH4++OH-=NH3·H2O,铵根消耗NaOH溶液的物质的量为3mol,则n(NH4+)=3mol;含有Al3+,发生反应Al(OH)3+NaOH=NaAlO2+2H2O,消耗NaOH溶液的物质的量为1mol,则n(Al3+)=1mol;根据电荷守恒,则溶液中一定含有负离子,故一定含有SO42-,n(SO42)= ![]() =
=![]() =4mol;则该溶液中肯定含有的离子是H+,NH4+,Al3+,SO42;各离子的物质的量之比为
=4mol;则该溶液中肯定含有的离子是H+,NH4+,Al3+,SO42;各离子的物质的量之比为![]() ;
;
(2)最后溶液中无沉淀,说明溶液中不含Mg2+和Fe3+;
(3)NaOH的物质的量从8mol到9mol表示的是沉淀的溶解,最后变成0,是氢氧化铝的溶解,离子反应方程式为![]() O。
O。

【题目】有A、B、C、D、E、F六种元素,已知:
①它们位于三个不同短周期,核电荷数依次增大
②E元素的电离能数据见下表(kJ·mol-1):
I1 | I2 | I3 | I4 | … |
496 | 4562 | 6912 | 9540 | … |
③B与F分别同主族
④A、E分别都能与D按原子个数比1﹕1或2﹕l形成化合物
⑤B、C分别都能与D按原子个数比1﹕1或1﹕2形成化合物
(1)写出只含有A、B、D、E四种元素的两种无水盐的化学式_____________、______________
(2)B2A2分子中存在____个σ键,____个π键
(3)E2D2电子式____________