题目内容
(14分)下表为元素周期表的一部分:
 族 族周期 | | | | |||||
| 1 | ① | | | | | | | |
| 2 | | | | | | ② | | |
| 3 | ③ | | | ④ | | ⑤ | ⑥ | |
(1)写出元素④在周期表中的位置: ;
(2)②③⑤的原子半径由大到小的顺序为 ;
(3)④⑤⑥的气态氢化物的稳定性由强到弱的顺序是 ;
(4)①②③⑥中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中两种化
合物的电子式: 。
Ⅱ.由上述部分元素组成的物质间,在一定条件下,可以发生下图中的变化,其中A是一
种淡黄色固体。则:
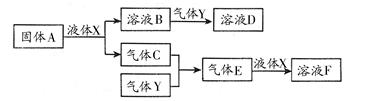
(1)写出固体A与液体X反应的离子方程式: ;
(2)气体Y是一种大气污染物,直接排放会形成酸雨。可用溶液B吸收,当B与Y物质的量之比为1∶1且恰好完全反应时,所得溶液D的溶质为 (填化学式);已知溶液D显酸性,则D溶液中各种离子浓度由大到小的顺序为 ;
(3)在100 mL 18 mol/L的F浓溶液中加入过量铜片,加热使之充分反应,产生气体的体积(标况下)可能为: 。
A.40.32 L B.30.24 L C.20.16 L D.13.44 L
(14分)
Ⅰ.⑴第三周期ⅣA族;(1分) ⑵ Na>S>O ;(2分)
⑶ HCl>H2S>SiH4 ;(2分) ⑷ Na+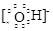 、
、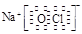 ;(2分)
;(2分)
Ⅱ.⑴ 2Na2O2 + 2H2O = 4Na+ + 4OH-+ O2↑;(2分)
⑵ NaHSO3;(1分) c(Na+)>c(HSO )>c(H+)>c(SO
)>c(H+)>c(SO )>c(OH-) ;(2分)
)>c(OH-) ;(2分)
⑶ D 。(2分)
解析试题分析:Ⅰ.根据元素周期表的结构判断①②③④⑤⑥分别是H、O、Na、Si、S、Cl元素。
(1)元素④Si在周期表中的位置是第三周期ⅣA族;
(2)②③⑤的原子半径由大到小的顺序为Na、S在第三周期,O在第二周期,Na在S的右侧,所以原子半径:Na>S>O;
(3)④⑤⑥元素的非金属性强弱顺序是Si<S<Cl,所以气态氢化物的稳定性由强到弱的顺序是HCl>H2S>SiH4;
(4)①②③⑥中的某些元素可形成既含离子键又含极性共价键的化合物,如NaOH、NaClO、NaClO3等,电子式为Na+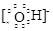 、
、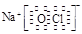 ;
;
Ⅱ.(1)A是一种淡黄色固体,由A能与某种液体反应,说明A是过氧化钠,该液体是水,二者反应的化学方程式为2Na2O2 + 2H2O = 4Na+ + 4OH-+ O2↑;
(2)溶液B是氢氧化钠溶液,气体C是氧气,气体Y是一种大气污染物,直接排放会形成酸雨。说明气体Y是二氧化硫。二氧化硫与氢氧化钠1:1完全反应时的产物根据元素守恒法可判断为NaHSO3;NaHSO3溶液显酸性,说明HSO3-的电离程度大于其水解程度,所以溶液中的离子浓度的大小关系是c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);
(3)F为硫酸,100 mL 18 mol/L的硫酸浓溶液中硫酸的物质的量是1.8mol,浓硫酸与Cu完全反应,最多生成0.9mol的二氧化硫,但随着反应的进行,硫酸浓度变稀,Cu不与稀硫酸反应,所以产生的二氧化硫的物质的量小于0.9mol,体积(标准状况)则小于20.16L,所以答案选D。
考点:考查对元素周期表的应用,元素判断及性质应用,电子式、离子方程式的书写,物质推断,溶液中离子浓度的比较,氧化还原反应的计算

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案决定物质性质的重要因素是物质的结构。请回答下列问题:
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
(2)已知:波长为300 nm的紫外光的光子,光子的能量与光的频率的关系为E=hv,式中h=6.63×10-34J·s,光的波长
 与光的频率v的关系为
与光的频率v的关系为 ,其中光速c=3×108m·s-1。根据下表有关蛋白质分子中重要化学键的信息,求波长为300 nm的紫外光的光子所具有的能量 kJ·mol-1,说明人体长时间照射紫外光后皮肤是否会受伤害的原因:
,其中光速c=3×108m·s-1。根据下表有关蛋白质分子中重要化学键的信息,求波长为300 nm的紫外光的光子所具有的能量 kJ·mol-1,说明人体长时间照射紫外光后皮肤是否会受伤害的原因: 。(未说明原因不给分)
| 共价键 | C—C | C—N | C—S |
| 键能/kJ·mol-1 | 347 | 305 | 259 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
(4)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 。
(5) [Cu(NH3)4]SO4中存在的化学键类型有 (填序号)。
A.共价键 B.氢键 C.离子键 D.配位键 E.分子间作用力
NH3分子的空间构型为 ,属于 分子(填“极性”或“非极性”)
(14分)下表列出了A—R九种元素在周期表中的位置,用元素符号或化学式填空。
 主族 主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | E | | F | | |
| 3 | A | C | D | | | | G | R |
| 4 | B | | | | | | H | |
(2)D元素的最高价氧化物对应的水化物与氢氧化钠溶液反应的离子方程式是 。
(3)A、B、C三种元素按原子半径由大到小的顺序排列的为 。
(4)F的氢化物的电子式 ;G、H 氢化物的稳定性递减的顺序是 。
(5)H元素跟A元素形成的化合物的化学式是 ;A2F2的电子式是 ;。
(6)B和F两种元素形成的2:1型化合物属于 (填“离子化合物”或“共价化合物”),请用电子式表示其形成过程 。
(7)国际无机化学命名委员会在1989年作出决定, 把元素周期表的主、副族及其族号取消, 由左至右改为1~18列。按这个规定,第15列元素应为 族元素,其简单氢化物的化学式为 (用字母“M”表示该族元素)
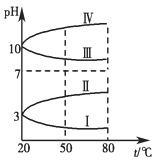
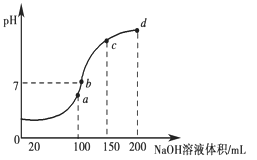
 , 试回答:
, 试回答: