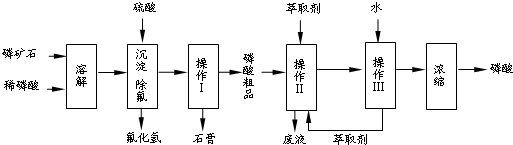
题目内容
2.为将反应2Al+6H+═2Al3++3H2↑的化学能转化为电能,下列装置能达到目的是(铝条均已除去了氧化膜)( )| A. | 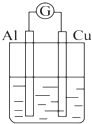 NaOH溶液 | B. | 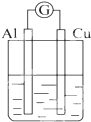 稀硫酸 | C. | 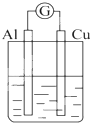 稀硝酸 | D. | 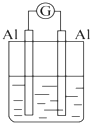 稀盐酸 |
分析 A.Al为负极,电解质为NaOH;
B.Al为负极,电解质为硫酸;
C.Al为负极,电解质为硝酸;
D.两电极相同,不能构成原电池.
解答 解:A.为原电池,总反应为:2Al+2OH-+2H2O═2AlO2-+3H2↑,故A不选;
B.为原电池,总反应为2Al+6H+═2Al3++3H2↑,故B选;
C.为原电池,总反应为Al+4H++NO3-═Al3++NO↑+2H2O,故C不选;
D.两电极相同,不能构成原电池,故D不选;
故选B.
点评 本题考查原电池的总反应,注意判断装置及工作原理为解答的关键,明确正负极及电池总反应即可解答,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
12.下列图示与对应的叙述相符的是( )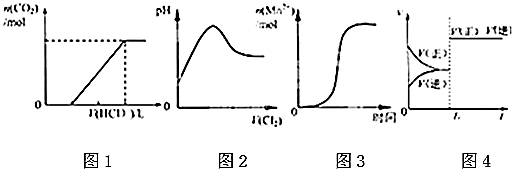

| A. | 图①表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| B. | 图②表示0.1000 mol•L-1NaOH溶液滴定20.00mL 0.1000 mol•L-1HCl溶液所得到的滴定曲线 | |
| C. | 图③表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂 | |
| D. | 图④表示某可逆反应生成物的量随反应时间变化的曲线,由图t时反应物转化率最大 |
13.下列排列顺序正确的是( )
①第一电离能Na<Al<Mg ②热稳定性:H2O>HF>NH3
③酸性:H3PO4>H2SO4>HClO4 ④结合质子能力OH->CH3COO->Cl-
⑤还原性:HF<HCl<HBr<HI ⑥离子半径:Ca2+<K+<Cl-<S2-.
①第一电离能Na<Al<Mg ②热稳定性:H2O>HF>NH3
③酸性:H3PO4>H2SO4>HClO4 ④结合质子能力OH->CH3COO->Cl-
⑤还原性:HF<HCl<HBr<HI ⑥离子半径:Ca2+<K+<Cl-<S2-.
| A. | ①②③④ | B. | ①④⑤⑥ | C. | ②③④⑤ | D. | ③④⑤⑥ |
10.下列操作达不到预期目的是( )
①石油分馏时把温度计插入液面以下;②用溴水除去乙烯中混有的SO2气体;③用乙醇与3mol/L的H2SO4混合共热到170℃制取乙烯;④将苯和溴水混合后加入Fe粉制溴苯;⑤将饱和食盐水滴入盛有电石的烧瓶中制乙炔.
①石油分馏时把温度计插入液面以下;②用溴水除去乙烯中混有的SO2气体;③用乙醇与3mol/L的H2SO4混合共热到170℃制取乙烯;④将苯和溴水混合后加入Fe粉制溴苯;⑤将饱和食盐水滴入盛有电石的烧瓶中制乙炔.
| A. | ①④ | B. | ③⑤ | C. | ②③④⑤ | D. | ①②③④ |
12.下列表示物质结构的化学用语或说法中,正确的是( )
| A. | CCl4分子的每个原子都满足8电子稳定结构 | |
| B. | HF的电子式: | |
| C. | 次氯酸的电子式: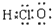 | |
| D. | NaCl的电子式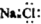 |


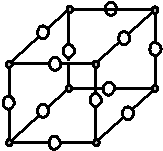 现有X、Y、Z、W原子序数依次增大的四种元素,常温下X元素单质的密度在自然界中最小,Y是短周期元素中未成对电子数与原子序数之比最大的原子,Z元素基态原子的核外电子排布式中,s亚层电子总数与p亚层电子总数相等,且Y与Z可形成多种气态化合物,W是常见的有色可变价金属单质,常温下可溶于Y的最高价氧化物水化物中,其基态原子的内层轨道全部排满电子,且最外层电子数为1.
现有X、Y、Z、W原子序数依次增大的四种元素,常温下X元素单质的密度在自然界中最小,Y是短周期元素中未成对电子数与原子序数之比最大的原子,Z元素基态原子的核外电子排布式中,s亚层电子总数与p亚层电子总数相等,且Y与Z可形成多种气态化合物,W是常见的有色可变价金属单质,常温下可溶于Y的最高价氧化物水化物中,其基态原子的内层轨道全部排满电子,且最外层电子数为1.