题目内容
(14分)氨气是一种重要的物质,可用于制取化肥和硝酸等。
(1)氨气催化氧化的化学方程式为 。
 (2)工业合成氨的热化学方程式为:N2(g)+3H2(g) 2NH3(g);△H=-92.2kJ/mol。
(2)工业合成氨的热化学方程式为:N2(g)+3H2(g) 2NH3(g);△H=-92.2kJ/mol。
有关键能:N="N945.6kJ/mol" N-H391.0kJ/mol,则H—H键能为 。
(3)500°C、50Mpa时,在容积为VL的定容器中加入n mol N2、3n mol H2,反应达到平衡后N2的转化率为a。则容器内气体的压强反应前与平衡时的比值为 。
(4)合成氨原料中的H2可用甲烷在高温下与水蒸气反应制得。部分1mol物质完全燃烧生成常温下稳定氧化物的△H数据如下表:
已知1 mol H2O(g)转变为1molH2O(l)时放热44.0kJ。写出CH4和水蒸气在高温下反应得到CO和H2的热化学方程式 。
(5)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl—NH4Cl为电解质溶液制取新型燃料电池。写出该电池的正极反应式 。
(6)若把标准状况下6.72L氨气通入到100g19.6%的硫酸溶液中,所得溶液中的溶质是
,溶液中离子浓度从大到小的顺序是 。
(1)氨气催化氧化的化学方程式为 。
 (2)工业合成氨的热化学方程式为:N2(g)+3H2(g) 2NH3(g);△H=-92.2kJ/mol。
(2)工业合成氨的热化学方程式为:N2(g)+3H2(g) 2NH3(g);△H=-92.2kJ/mol。有关键能:N="N945.6kJ/mol" N-H391.0kJ/mol,则H—H键能为 。
(3)500°C、50Mpa时,在容积为VL的定容器中加入n mol N2、3n mol H2,反应达到平衡后N2的转化率为a。则容器内气体的压强反应前与平衡时的比值为 。
(4)合成氨原料中的H2可用甲烷在高温下与水蒸气反应制得。部分1mol物质完全燃烧生成常温下稳定氧化物的△H数据如下表:
| 物质 | △H(kJ/mol) |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
(5)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl—NH4Cl为电解质溶液制取新型燃料电池。写出该电池的正极反应式 。
(6)若把标准状况下6.72L氨气通入到100g19.6%的硫酸溶液中,所得溶液中的溶质是
,溶液中离子浓度从大到小的顺序是 。
(1)

(2)436.1kJ/mol
(3)
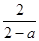
(4)CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ/mol
(5)N2+8H++6e-=2NH+4
(6)硫酸铵和硫酸氢铵;c(NH+4)>c(SO2-4)>c(H+)>c(OH-)
(1)氨气催化氧化的化学方程式为:4NH3+5O2 4NO+6H2O
4NO+6H2O
(2)945.6+3(H-H)-6×391.0=-92.2 H-H的键能=436.1kJ/mol
(3)N2+ 3H2 2NH3
2NH3
起始 n 3n 0
转化 na 3na 2na
平衡n(1-a) 3n(1-a) 2na
起始的物质的量为4n,平衡时的物质的量为n(1-a)+ 3n(1-a)+2na=4n-2na
则容器内气体的压强反应前与平衡时的比值为2/(2-a)
(4)CH4和水蒸气在高温下反应得到CO和H2的热化学方程式:
CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ/mol
(5)正极反应是:N2+8H++6e-=2NH4+
(6)所得溶液中的溶质是硫酸铵和硫酸氢铵,溶液中离子浓度从大到小的顺序是:c(NH+4)>c(SO2-4)>c(H+)>c(OH-)
 4NO+6H2O
4NO+6H2O(2)945.6+3(H-H)-6×391.0=-92.2 H-H的键能=436.1kJ/mol
(3)N2+ 3H2
 2NH3
2NH3起始 n 3n 0
转化 na 3na 2na
平衡n(1-a) 3n(1-a) 2na
起始的物质的量为4n,平衡时的物质的量为n(1-a)+ 3n(1-a)+2na=4n-2na
则容器内气体的压强反应前与平衡时的比值为2/(2-a)
(4)CH4和水蒸气在高温下反应得到CO和H2的热化学方程式:
CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ/mol
(5)正极反应是:N2+8H++6e-=2NH4+
(6)所得溶液中的溶质是硫酸铵和硫酸氢铵,溶液中离子浓度从大到小的顺序是:c(NH+4)>c(SO2-4)>c(H+)>c(OH-)

练习册系列答案
相关题目
 HNO3+N2+H2O(未配平),被氧化的N原子与被还原的N原子的物质的量之比是( )
HNO3+N2+H2O(未配平),被氧化的N原子与被还原的N原子的物质的量之比是( ) mol·L-1
mol·L-1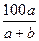 %
%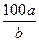 g
g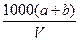 g·L-1
g·L-1