题目内容
19.可逆反应:在密闭容器反应2NO2?2NO+O2,达到平衡状态的标志是( )(1)单位时间内生成2moL NO2的同时生成2moL NO
(2)单位时间内生成2moL NO的同时,生成1moL O2
(3)用反应物和生成物的物质的量浓度变化表示反应速率的比为2:2:1的状态
(4)混合气体的颜色不再改变的状态
(5)混合气体的平均相对分子质量不再改变的状态.
| A. | (1)(4)(5) | B. | (2)(3)(5) | C. | (1)(3)(4) | D. | (1)(2)(3)(4)(5) |
分析 ①生成了2n mol NO2,同时消耗n molO2,说明氧气的生成和消耗速率相等;
②都是正反应速率,无法判断是否达到平衡;
③气体的物质的量大小无法判断是否达到平衡;
④混合气体中,只有二氧化氮是有色的,颜色不变,生成和消耗速率相等,达到了平衡;
⑤混合气体的平均相对分子质量=$\frac{气体的总重量}{气体的总物质的量}$.
解答 解:①根据单位时间内生成n molO2的同时生成2n mol NO2 ,可知生成氧气的速率和消耗速率相等,达到了平衡状态,故①正确;
②单位时间内生成n molO2的同时生成2n mol NO,都是正反应速率,无法判断是否达到平衡,故②错误;
③气体的物质的量之比无法判断正逆反应速率,故③错误;
④二氧化氮颜色不变,说明生成的二氧化氮和消耗的速率相等,达到了平衡状态,故④正确;
⑤反应物和生成物都是气体,反应前后气体质量不变,物质的量不同,平均相对分子质量不再改变,说明反应达到平衡状态,故⑤正确;
故选A.
点评 本题考查化学平衡状态的判断,难度不大,做题时注意分析化学方程式的前后计量数大小的关系.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.“Cl化学”是指以碳单质或分子中含有1个碳原子的物质(如CO、CO2、CH4、CH3OH等)为原料合成工业产品的工艺,对开发新能源和控制环境污染有重要意义.

(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol相关数据如下
请回答:①c1=c2(填“>”“<”或“=”),a=19.6
②若甲中反应10s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是0.03mol)L.s)
(2)压强为p1时,向体积为1L密闭容器中充入bmolCO和2bmolH2,发生反应CO(g)+2H2(g)?CH3OH(g)
,平衡时CO的转化率与温度、压强的关系如图1所示,请回答:
①该反应属于放(填“吸”或“放”)热反应,p1<p2(填“>”“<”或“=”)
②100℃时,该反应的平衡常数K=$\frac{1}{{b}^{2}}$(用含b的代数式表示)
(3)治理汽车尾气的反应是2NO(g)+2CO(g)?2CO2+N2(g)在常温下能够自发进行,则它的△H<0.(填>、<).在恒温容的密闭容器中通入n(NO):n(CO)=1:2的混合气体,发生上述反应,下列图象说明反应在进行到t1时刻一定达到平衡状态的是cd(选填字母)

(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol相关数据如下
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2(g)和3molH2(g) | 1molCH3OH和1molH2O(g) |
| 平衡时c(CH3OH) | c1 | c2 |
| 平衡时能量变化 | 放出29.4kJ | 吸收akJ |
②若甲中反应10s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是0.03mol)L.s)
(2)压强为p1时,向体积为1L密闭容器中充入bmolCO和2bmolH2,发生反应CO(g)+2H2(g)?CH3OH(g)
,平衡时CO的转化率与温度、压强的关系如图1所示,请回答:
①该反应属于放(填“吸”或“放”)热反应,p1<p2(填“>”“<”或“=”)
②100℃时,该反应的平衡常数K=$\frac{1}{{b}^{2}}$(用含b的代数式表示)
(3)治理汽车尾气的反应是2NO(g)+2CO(g)?2CO2+N2(g)在常温下能够自发进行,则它的△H<0.(填>、<).在恒温容的密闭容器中通入n(NO):n(CO)=1:2的混合气体,发生上述反应,下列图象说明反应在进行到t1时刻一定达到平衡状态的是cd(选填字母)
10.下列各组中的性质比较中,正确的有( )
| A. | 酸性 HClO4>HBrO4>HIO4 | B. | 碱性 Ba(OH)2>Ca(OH)2>Mg(OH)2 | ||
| C. | 非金属性 F>Cl>Br | D. | 稳定性 HCl>H2S>PH3 |
7.原子序数大于4的主族元素X、Y的离子Xm+ Yn-,两者核外电子排布相同,关于X、Y的叙述正确的是( )
| A. | X和Y在同一周期 | B. | 离子半径X一定大于Y | ||
| C. | 两元素族序数之差为8-m-n | D. | X、Y核电荷数之差为8-m-n |
14.下列电子式正确的是( )
| A. | 氨气: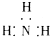 | B. | 四氯化碳: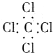 | C. | 氮气: | D. | 二氧化碳: |
4.下列有机物中,不能与金属钠反应放出氢气的是( )
| A. | 乙醇 | B. | 乙烯 | C. | 乙酸 | D. | 碳酸钠溶液 |
11.下表是稀硫酸与某金属反应的实验数据:
分析上述数据,回答下列问题:
(1)实验4和5表明固体反应物的表面积对反应速率有影响.
(2)在前4次实验中,能表明反应物浓度对反应速率产生影响的实验有1、3、4(填实验序号).
(3)其实验6和其实验7表明温度对反应速率有影响.
(4)实验中,反应前后溶液的温度变化值(约15℃)相近,推测其原因:可能是硫酸过量,等质量的金属完全反应,放出的热量相等,所以使等体积溶液的温度升高值相近.
| 实验 序号 | 金属 质量/g | 金属 状态 | c(H2SO4)/mol•L-1 | v(H2SO4)/mL | 溶液温度/℃ | 金属消失的时间/S | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 20 | 44 | 40 |
(1)实验4和5表明固体反应物的表面积对反应速率有影响.
(2)在前4次实验中,能表明反应物浓度对反应速率产生影响的实验有1、3、4(填实验序号).
(3)其实验6和其实验7表明温度对反应速率有影响.
(4)实验中,反应前后溶液的温度变化值(约15℃)相近,推测其原因:可能是硫酸过量,等质量的金属完全反应,放出的热量相等,所以使等体积溶液的温度升高值相近.

 某温度时,在5L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.请通过计算回答下列问题:
某温度时,在5L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.请通过计算回答下列问题: