题目内容
【题目】(1)A、B、C、D、E均是短周期元素,其原子序数依次增大,A和B同周期,A原子最外层电子数是内层电子数的二倍,B元素族序数是周期数的三倍,B的阴离子与C的阳离子电子层结构相同,C的单质与B的单质在不同条件下反应,可生成C2B或C2B2,D单质是一种淡黄色固体。请回答:
①C2B2的电子式是___________,D、E可形成化合物DE2中,存在下列哪些静电作用力______。
a.极性键 b.非极性键 c.范德华力 d.氢键 e.离子键
②B、C、E的离子半径由大到小的顺序为_______________(用化学式回答),举一个事实证明E和D非金属性的强弱___________________(用离子反应方程式表示)。
(2)氨和二氧化碳反应可生成尿素CO(NH2)2。尿素在一定条件下会失去氨而缩合,如两分子尿素失去一分子氨形成二聚物:

当尿素三聚时,得到两种产物,其中一种为环状结构,请画出其结构式___________。
(3)已知某元素的原子序数是33,试推测该元素:
①原子的原子结构示意图______________。
②在元素周期表中的位置______________。
【答案】![]() ac Cl->O2->Na+ Cl2+S2-=S+2Cl-
ac Cl->O2->Na+ Cl2+S2-=S+2Cl- 
 第四周第VA族
第四周第VA族
【解析】
(1)A、B、C、D、E均是短周期元素,其原子序数依次增大,A原子最外层电子数是内层电子数的二倍,则A核外电子排布是2、4,所以A为碳元素, A和B同周期,B元素族序数是周期数的三倍,则B核外电子排布是2、6,所以B为氧元素,B的阴离子与C的阳离子电子层结构相同,C的单质与B 的单质在不同条件下反应,可生成C2B或C2B2,则C为钠元素,D单质是一种淡黄色固体,则D为硫元素,原子序数比D的短周期元素E是氯元素,然后根据元素周期律及物质结构分析解答;
(2)根据脱氨缩合时,一个分子中氨基与另一个分子中-NH2的H原子结合形成NH3,其余结合在一起,根据要求写出物质结构式;
(3)根据原子核外电子排布规律,书写其核外电子排布式;然后根据原子结构与元素在周期表的位置关系确定其所在的位置。
(1)根据上述推断可知:A是C,B是O,C是Na,D是S,E是Cl元素。
①C2B2是Na2O2,该物质是离子化合物,Na+与O22-之间通过离子键结合,O22-中2个O原子之间通过共价键结合,所以用电子式表示为:![]() ;D、E形成的化合物DE2是SCl2,该物质由分子构成的分子晶体,S原子与Cl通过极性共价键S-Cl结合,分子之间存在范德华力,故合理选项是ac;
;D、E形成的化合物DE2是SCl2,该物质由分子构成的分子晶体,S原子与Cl通过极性共价键S-Cl结合,分子之间存在范德华力,故合理选项是ac;
②B是O,C是Na, E是Cl,它们形成的离子中,Na+、O2-核外有2个电子层,电子层结构相同;Cl-有3个电子层,离子核外电子层数越多,离子半径越大;当离子核外电子层数相同时,离子的核电荷数越大,离子半径越小,所以三种离子的半径由大到小的顺序为:Cl->O2->Na+;
元素的非金属性越强,其单质的氧化性就越强。可通过两种元素单质之间的置换反应Cl2+S2-=S+2Cl-,来证明元素的非金属性:Cl>S;
(2)根据尿素脱氨缩合时特点:一个分子中氨基-NH2与另一个分子中-NH2的H原子结合形成NH3,其余结合在一起,则尿素三聚时,得到两种产物,一种是NH3,另一种为环状结构,其结构式为: ;
;
(3)根据原子核外电子排布遵循的规律,可知原子序数为33的元素核外电子排布式是 ,可见该元素原子核外有四个电子层,最外层有5个电子,因此其在元素周期表的位置是位于第四周期第VA族。
,可见该元素原子核外有四个电子层,最外层有5个电子,因此其在元素周期表的位置是位于第四周期第VA族。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 稀硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | KMnO4 | Cl2 | NaOH溶液 |
A.AB.BC.CD.D
【题目】碳、氮、硫的化合物在生产生活中广泛存在。请回答:
(1)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-l59.5kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(l) ΔH=-160.5kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式__。
(2)T温度时在容积为2L的恒容密闭容器中只充入1.00molNO2气体发生反应:2NO(g)+O2(g)![]() 2NO2(g) H<0。不同时刻测得容器中n(NO2)如下表:
2NO2(g) H<0。不同时刻测得容器中n(NO2)如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
①升高温度K值___(增大、减小),T温度时化学平衡常数K=___mol-1·L
②从0~2s该反应的平均速率v(NO2)=___。
③对可逆反应2NO(g)+O2(g)![]() 2NO2(g) H<0。恒温,恒容密闭容器中,下列说法中,能说明该反应达到化学平衡状态的是___。
2NO2(g) H<0。恒温,恒容密闭容器中,下列说法中,能说明该反应达到化学平衡状态的是___。
A.混合气体的密度不再变化
B.混合气体的压强不再变化
C.氧气的转化率不再变化
D.N2、O2、NO的物质的量之比为1:1:2
(3)常温下,用SO2与NaOH溶液反应可得到NaHSO3、Na2SO3等。
①已知Na2SO3水溶液显碱性,原因是___(写出主要反应的离子方程式),该溶液中,c(Na+)___2c(SO32-)+c(HSO3-)(填“>”“<”或“=”)。
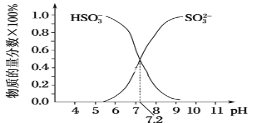
②在某NaHSO3、Na2SO3混合溶液中HSO3-、SO32-物质的量分数随pH变化曲线如图所示(部分),根据图示,则SO32-的第一步水解平衡常数=____。