题目内容
16.对于反应A2+3B2═2C+2D(A、B、C、D全为气体)来说,以下化学反应速率的表示中,反应速率最快的是( )| A. | v(B2)=0.8 mol/(L•s) | B. | v(A2)=0.4 mol/(L•s) | C. | v(C)=0.6 mol/(L•s) | D. | v(D)=1.2 mol/(L•s) |
分析 化学反应速率之比等于化学计量数之比,则反应速率与化学计量数的比值越大,反应速率越快,以此来解答.
解答 解:反应速率与化学计量数的比值越大,反应速率越快,则
A.$\frac{0.8}{3}$=0.26;
B.$\frac{0.4}{1}$=0.4;
C.$\frac{0.6}{2}$=0.3;
D.$\frac{1.2}{2}$=0.6,
显然D中比值最大,反应速率最快,
故选D.
点评 本题考查反应速率的比较,为高频考点,把握化学计量数与反应速率的关系为解答的关键,侧重分析与应用能力的考查,注意比值法应用及速率单位统一,题目难度不大.

练习册系列答案
相关题目
4.化学与生活密切相关,下列有关说法正确的是( )
| A. | 煤通过干馏、气化和液化三个物理变化过程,可变为洁净的燃料和多种化工原料 | |
| B. | 糖尿病人应少吃含糖类的食品,可常喝糯米八宝粥 | |
| C. | 维生素C具有还原性,能在人体内起抗氧化作用 | |
| D. | 糖类、蛋白质、油脂都属于天然高分子化合物 |
7.下列说法不正确的是( )
| A. | NH4Cl溶液呈酸性说明NH3•H2O是弱电解质 | |
| B. | CH3COONa溶液中c(Na+)>c(CH3COO-) | |
| C. | 常温下相同pH的NaOH溶液和CH3COONa溶液中水电离出的OH-浓度相同 | |
| D. | 常温下,在1 mol•L-1的盐酸溶液中加入等体积等浓度的氨水,溶液导电能力减弱 |
11.常温下,Ka (HCOOH)=1.77×10-4,Ka (CH3COOH)=1.75×10-5,Kb (NH3•H2O)=1.76×10-5,下列说法正确的是( )
| A. | 浓度均为0.1 mol•L-1的 HCOONa和NH4Cl 溶液中阳离子的物质的量浓度之和:前者小于后者 | |
| B. | 用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积相等 | |
| C. | 0.2 mol•L-1 HCOOH 与 0.1 mol•L-1 NaOH 等体积混合后的溶液中:c(HCOO-)+c(OH-)=c(HCOOH)+c(H+) | |
| D. | 0.10 mol•L-1CH3COONa溶液中通入HCl至溶液呈中性:c(Na+)>c(Cl-)=c(CH3COOH) |
1.下列既能发生氧化还原反应,又能发生复分解反应的离子组是( )
| A. | Na+、H+、ClO-、S2- | B. | NH4+、Na+、MnO4-、I- | ||
| C. | K+、Ba2+、Br-、NO3- | D. | Mg2+、Ag+、OH-、PO43- |
8.反应N2+3H2?2NH3在密闭容器内进行.分别用N2、H2、NH3三种物质在单位时间内浓度的变化表示该反应的速率为v(N2)、v(H2)、v(NH3),则三者的关系正确的是( )
| A. | v(N2)=v(NH3) | B. | 3v(H2)=2v(NH3) | C. | v(NH3)=$\frac{3}{2}$v(H2) | D. | v(H2)=3v(N2) |
5.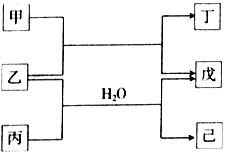 短周期元素E、R、X、Y、Z的原子序数依次增大,它们组成的单质或化合物存在如下转化关系,甲、丁为二元化合物,乙、戊为单质,丙、己为三元化合物.已知25℃时,0.1mol•L-1甲、丙两溶液的pH分别为1、13,丁、己两溶液混合时产生白色沉淀.下列说法正确的是( )
短周期元素E、R、X、Y、Z的原子序数依次增大,它们组成的单质或化合物存在如下转化关系,甲、丁为二元化合物,乙、戊为单质,丙、己为三元化合物.已知25℃时,0.1mol•L-1甲、丙两溶液的pH分别为1、13,丁、己两溶液混合时产生白色沉淀.下列说法正确的是( )
 短周期元素E、R、X、Y、Z的原子序数依次增大,它们组成的单质或化合物存在如下转化关系,甲、丁为二元化合物,乙、戊为单质,丙、己为三元化合物.已知25℃时,0.1mol•L-1甲、丙两溶液的pH分别为1、13,丁、己两溶液混合时产生白色沉淀.下列说法正确的是( )
短周期元素E、R、X、Y、Z的原子序数依次增大,它们组成的单质或化合物存在如下转化关系,甲、丁为二元化合物,乙、戊为单质,丙、己为三元化合物.已知25℃时,0.1mol•L-1甲、丙两溶液的pH分别为1、13,丁、己两溶液混合时产生白色沉淀.下列说法正确的是( )| A. | 原子半径的大小Z>Y>X>R>E | |
| B. | X、Y、Z的最高价氧化物对应的水化物能相互反应 | |
| C. | E、R、Z三种元素不可能存在于同一种共价化合物中 | |
| D. | Z的阴离子夺取质子的能力较R的阴离子强 |
 、④
、④ 等,
等,