题目内容
10.很多不饱和有机物在Ni催化下可以与H2 发生加成反应.如①CH 2 =CH 2 、②CH≡CH、③
 、④
、④ 等,
等,其中分子中C原子为SP2杂化的有①③④ (填物质序号),预测HCHO分子的立体结构为平面三角形.
分析 根据杂化轨道数判断杂化类型,杂化轨道数=δ键数+孤对电子对数;根据杂化轨道方式及杂化轨道成键情况判断HCHO立体结构.
解答 解:①CH2=CH2中碳原子成2个C-Hδ键,1个碳碳双键,双键中含有1个δ键、1个π键,杂化轨道数为2+1=3,所以碳原子采取sp2杂化;
②CH≡CH中碳原子成2个C-Hδ键,1个碳碳三键,三键中含有1个δ键、2个π键,杂化轨道数为1+1=2,所以碳原子采取sp杂化;
③苯中碳原子成1个C-Hδ键,2个C-Cδ键,同时参与成大π键,杂化轨道数为1+2=3,所以碳原子采取sp2杂化;
④HCHO中碳原子成2个C-Hδ键,1个碳氧双键,双键中含有1个δ键、1个π键,杂化轨道数为2+1=3,所以碳原子采取sp2杂化;
故①、③、④采取sp2杂化.
HCHO中碳原子采取sp2杂化,杂化轨道为平面正三角形,未容纳孤对电子对,全部成δ键,参与成键的原子不同,所以HCHO为平面三角形.
故答案为:①③④;平面三角.
点评 本题考查了杂化类型的判断、分子的空间构型,题目难度不大,注意把握价层电子对数的判断方法,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
16.对于反应A2+3B2═2C+2D(A、B、C、D全为气体)来说,以下化学反应速率的表示中,反应速率最快的是( )
| A. | v(B2)=0.8 mol/(L•s) | B. | v(A2)=0.4 mol/(L•s) | C. | v(C)=0.6 mol/(L•s) | D. | v(D)=1.2 mol/(L•s) |
17.美国科学家目前开发出了一种新技术,将能放射出α粒子的碳原子装入形状类似DNA螺旋结构的碳纳米管中,这种肉眼看不见的微型“核弹”可以搜索、确认并定向摧毁身体任何部位的癌细胞.下列有关说法中正确的是( )
| A. | 放射性At原子中,核外电子与核内中子数之差为133 | |
| B. | 根据元素周期律推知:砹单质是-种有色固体,AgAt是一种不溶于水的固体 | |
| C. | 类似DNA螺旋结构的碳纳米管是一种高分子化合物 | |
| D. | 构成碳纳米管的微粒直径在1nm~100nm之间,它实际上是一种胶体 |
14.甲、乙两烧杯中各盛有100mL 6mol/L的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为1:2,则加入铝粉的质量为( )
| A. | 10.8g | B. | 7.2g | C. | 5.4g | D. | 3.6g |
5. 电解尿素[CO(NH2)2]是一种能耗很低的制氢方法,其工作原理如图所示,总反应为CO(NH2)2+2OH-$\frac{\underline{\;通电\;}}{\;}$N2↑+3H2↑+CO32-.下列说法错误的是( )
电解尿素[CO(NH2)2]是一种能耗很低的制氢方法,其工作原理如图所示,总反应为CO(NH2)2+2OH-$\frac{\underline{\;通电\;}}{\;}$N2↑+3H2↑+CO32-.下列说法错误的是( )
 电解尿素[CO(NH2)2]是一种能耗很低的制氢方法,其工作原理如图所示,总反应为CO(NH2)2+2OH-$\frac{\underline{\;通电\;}}{\;}$N2↑+3H2↑+CO32-.下列说法错误的是( )
电解尿素[CO(NH2)2]是一种能耗很低的制氢方法,其工作原理如图所示,总反应为CO(NH2)2+2OH-$\frac{\underline{\;通电\;}}{\;}$N2↑+3H2↑+CO32-.下列说法错误的是( )| A. | 阴极的材料可选择钢铁制品 | |
| B. | 电解池工作时,阳极区域溶液的pH减小 | |
| C. | 阳极的电极反应式为CO(NH2)2+8OH--6e-═N2↑+CO32-+6H2O | |
| D. | 若电路中通过3 mol 电子,则生成气体的总体积为33.6L(标准状况) |
15.食品保鲜膜按材质分为聚乙烯(PE)、聚氯乙烯(PVC)等种类,PE 保鲜膜可直接接 触食品,PVC 保鲜膜则不能直接接触食品,它对人体有潜在危害.下列有关叙述不正 确的是( )
| A. | PE、PVC 都属于高分子化合物 | |
| B. | 质量相同的乙烯和聚乙烯完全燃烧耗氧量相同 | |
| C. | 乙烯和氯乙烯都是不饱和烃,二者都能使溴水褪色,而 PE、PVC 不能使溴水褪色 | |
| D. | 回利用废弃的 PE 和 PVC 可减少白色污染,焚烧 PVC 膜会放出有毒气体如 HCl |
2.下面的排序不正确的是( )
| A. | 硬度由大到小:金刚石>碳化硅>晶体硅 | |
| B. | 晶格能由大到小:NaF>NaCl>NaBr>NaI | |
| C. | 晶体熔点由低到高:CF4<CCl4<CBr4<CI4 | |
| D. | 熔点由高到低:Na>Mg>Al |
19.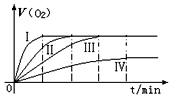 某实验小组以 H2O2分解为例,研究浓度、催化剂、温度对反应速率的影响.按照如下方案完成实验.通过实验得到氧气的体积与时间的关系如图所示,回答下列问题:
某实验小组以 H2O2分解为例,研究浓度、催化剂、温度对反应速率的影响.按照如下方案完成实验.通过实验得到氧气的体积与时间的关系如图所示,回答下列问题:
(1)代表实验①的图示是Ⅳ.
(2)对比实验③和④的目的是探究催化剂对反应速率的影响.
(3)通过上面对比实验,所得的实验结论是其他条件不变,增大反应物浓度或升高温度或加入催化剂,化学反应速率加快.
 某实验小组以 H2O2分解为例,研究浓度、催化剂、温度对反应速率的影响.按照如下方案完成实验.通过实验得到氧气的体积与时间的关系如图所示,回答下列问题:
某实验小组以 H2O2分解为例,研究浓度、催化剂、温度对反应速率的影响.按照如下方案完成实验.通过实验得到氧气的体积与时间的关系如图所示,回答下列问题:| 反应物 | 催化剂 | 温度 | |
| ① | 10mL10% H2O2溶液 | 无 | 25℃ |
| ② | 10mL20% H2O2溶液 | 无 | 25℃ |
| ③ | 10mL20% H2O2溶液 | 无 | 40℃ |
| ④ | 10mL20% H2O2溶液 | 1~2滴0.1mol/L FeCl3溶液 | 40℃ |
(2)对比实验③和④的目的是探究催化剂对反应速率的影响.
(3)通过上面对比实验,所得的实验结论是其他条件不变,增大反应物浓度或升高温度或加入催化剂,化学反应速率加快.
20.只用一种试剂就能将 、
、 、CH3CH2OH鉴别出来,该试剂是( )
、CH3CH2OH鉴别出来,该试剂是( )
 、
、 、CH3CH2OH鉴别出来,该试剂是( )
、CH3CH2OH鉴别出来,该试剂是( )| A. | 溴水 | B. | NaOH溶液 | C. | 饱和Na2CO3溶液 | D. | 银氨溶液 |