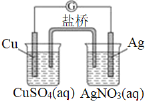
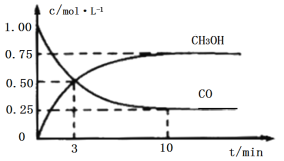
��Ŀ����
����Ŀ��T��ʱ����2L�����ܱ������г���1mol NO2��2mol SO2�������·�Ӧ��
NO2(g)+SO2(g) SO3(g)+NO(g) ��H=��41.8kJ/mol��
(1)������˵���÷�Ӧ�ﵽƽ��״̬����__________��
a����ϵѹǿ���ֲ���
b�����������ɫ���ֲ���
c��SO3��NO������ȱ��ֲ���
d��ÿ����n mol SO3��ͬʱ����n mol NO2
(2)��Ӧ���е�20s ʱ����÷�Ӧ����v(NO)=0.005mol/(Ls)�������ĵ�NO2Ϊ______mol��
(3)����������Ϊ��������(��������Ƚ���)����ƽ������ʱ�佫_________��
a���ӳ� b������ c������ d����ȷ��
���𰸡�b 0.2 b
��������
(1)���淴Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ������ʵ����ʵ��������ʵ���Ũ�ȡ��ٷֺ������ɴ������һϵ�����������䣻
(2)ͬһ���淴Ӧͬһʱ����ڸ����ʵķ�Ӧ����֮�ȵ��ڻ�ѧ������֮�ȣ��ݴ˼������������Ӧ���ʣ��ٸ���n=vtV��������������ʵ�����
(3)����������Ϊ��������(��������Ƚ���)���÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ�������൱�������¶ȣ���Ӧ���ʼӿ졣
(1)a���÷�Ӧ��һ����Ӧǰ�����廯ѧ������֮�Ͳ���Ŀ��淴Ӧ������ѹǿʼ�ղ��䣬������ϵѹǿ���ֲ��䲻��˵���÷�Ӧ�ﵽƽ��״̬����a��ѡ��
b�����������ɫ���ֲ��䣬˵����������Ũ�Ȳ��䣬���Ը÷�Ӧ�ﵽƽ��״̬����bѡ��
c����ʼͶ��NO2��SO2������ƽ�������SO3��NO�������ʼ��Ϊ1:1��SO3��NO������ȱ��ֲ��䲻��˵����Ӧ�ﵽƽ��״̬����c����
d�����۸÷�Ӧ�Ƿ�ﵽƽ��״̬��������ÿ����n mol SO3��ͬʱ����n mol NO2�����Բ��ܾݴ��ж�ƽ��״̬����d��ѡ��
�ʴ�ѡb��
(2)ͬһ���淴Ӧͬһʱ����ڸ����ʵķ�Ӧ����֮�ȵ��ڻ�ѧ������֮�ȣ�v(NO2)=v(NO)=0.005molL1s1��v=![]() ��n=vtV�������ĵ�NO2���ʵ���n(NO2)=0.005molL1s1��20s��2L=0.2mol��
��n=vtV�������ĵ�NO2���ʵ���n(NO2)=0.005molL1s1��20s��2L=0.2mol��
(3)����������Ϊ��������(��������Ƚ���)���÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ�������൱�������¶ȣ���Ӧ���ʼӿ죬�����̷�Ӧ�ﵽƽ��ʱ�䣬��ѡb��

����Ŀ����3�ֲ�ͬ�����£��ֱ����ݻ�Ϊ2L�ĺ����ܱ������г���2molA��1molB��������Ӧ:2A(g)+B(g)![]() 2D(g)��H=QkJ/mol��������������ݼ��±�:
2D(g)��H=QkJ/mol��������������ݼ��±�:
ʵ���� | ʵ��I | ʵ��II | ʵ��III |
��Ӧ�¶�/�� | 700 | 700 | 750 |
��ƽ��ʱ��/min | 40 | 50 | 30 |
n(D)ƽ��/mol | 1.5 | 1.5 | 1 |
��ѧƽ�ⳣ�� | K1 | K2 | K3 |
����˵����ȷ����
A. �����¶��ܼӿ췴Ӧ���ʵ�ԭ���ǽ����˷�Ӧ�Ļ�ܣ�ʹ����Ӱٷ������
B. ʵ��III��ƽ����������������䣬����������ͨ��1molA��1molD��ƽ�ⲻ�ƶ�
C. ʵ��III��ƽ��������ڵ�ѹǿ��ʵ��1��9/10��
D. K3>K2>K1
����Ŀ�������������ʵ���Ҫ���������ʽṹ����ش��������⣺
(1)��֪Ԫ��M���������Ca5(PO4)3F��һ��Ԫ�ء�Ԫ��M����̬ԭ�����ʧȥ��1������5��������������(�������ܣ��÷���I1��I��ʾ)�����ʾ��
I1 | I2 | I3 | I4 | I5 | |
������(kJ/mol) | 589.8 | 1145.4 | 4912.4 | 6491 | 8153 |
Ԫ��M����̬�������ϼ���___________�ۣ����̬ԭ�ӵ����Ų�ʽΪ___________��
(2)������ͭ��Һ�м��������ˮ�����γ�[Cu(NH3)4]SO4����Һ������Һ�������ܽ���ά�ء�
��[Cu(NH3)4]SO4�������ӵ����幹����___________��
�ڳ���Ԫ���⣬[Cu(NH3)4]SO4������Ԫ�صĵ縺����С�����˳��Ϊ___________��
��NF3��NH3�Ŀռ乹����ͬ������ԭ�ӵĹ���ӻ����;�Ϊ___________����NF3������Cu2+�γɻ�ѧ������ԭ����___________��
(3)һ��Hg-Ba-Cu-O���³������ϵľ���(������)��ͼ��ʾ��
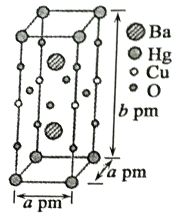
�ٸ����ʵĻ�ѧʽΪ___________��
����֪�þ���������Ba2+�ļ��Ϊcpm�������Ba2+�����Hg+��ĿΪ___________�������ߵ���̾���Ϊ___________pm��(�г�����ʽ���ɣ���ͬ)
��������ʵ�Ħ������ΪM�������ӵ�������ֵΪNA����þ�����ܶ�Ϊ___________g��cm��3��