题目内容
【题目】生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到的滤液用 NaHCO3溶液处理,测得溶液的pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下图所示。下列有关说法错误的是
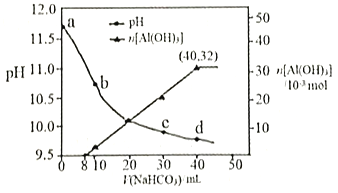
A. a点溶液中存在:c(Na+)+c(H+)=c(AlO2-)+c(OH-)
B. 水的电离程度:a点小于c点
C. 原 NaHCO3溶液中c(H2CO3)+c(HCO3-)+c(CO32-)=0.8mol·L-1
D. 生成沉淀的离子方程式为HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-
【答案】C
【解析】
根据题意可知a点为偏铝酸钠和氢氧化钠混合溶液,0mL~8mL碳酸氢钠与过量的氢氧化钠反应,8mL~32mL碳酸氢钠与偏铝酸钠反应,据此分析选项是否正确。
A.a点为偏铝酸钠和氢氧化钠混合溶液,根据电荷守恒可以写出:c(Na+)+c(H+)=c(AlO2-)+c(OH-),A正确;
B.水的电离程度:a点为偏铝酸钠和氢氧化钠的混合液, c点为偏铝酸钠与碳酸钠的混合液,因为酸碱抑制水的电离,盐类水解促进水的电离,所以水的电离程度:a点小于c点,B正确;
C.加入40mLNaHCO3溶液时沉淀最多,沉淀为0.032mol,前8mLNaHCO3溶液和氢氧化钠反应(OH-+HCO3-=CO32-+H2O)不生成沉淀,后32mLNaHCO3溶液与偏铝酸钠反应(HCO3-+AlO2-+H2O═Al(OH)3↓+CO32-)生成沉淀,则原NaHCO3溶液物质的量浓度c(NaHCO3)=![]() =1.0mol/L,原NaHCO3溶液中的物料守恒为c(HCO3-)+c(CO32-)+c(H2CO3)=1.0mol/L,C错误;
=1.0mol/L,原NaHCO3溶液中的物料守恒为c(HCO3-)+c(CO32-)+c(H2CO3)=1.0mol/L,C错误;
D.根据强酸制弱酸原理可以写出离子方程式HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-,D正确;
正确答案:C。

【题目】已知化学反应①:Fe(s)+CO2(g) ![]() FeO(s)+CO(g),其平衡常数为K1;化 反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;化 反应②:Fe(s)+H2O(g) ![]() FeO(s)+H2(g),其平衡常数为K2,在温度973 K和1173 K情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其平衡常数为K2,在温度973 K和1173 K情况下,K1、K2的值分别如下:
温度 | K1 | K2 |
973 K | 1.47 | 2.38 |
1173 K | 2.15 | 1.67 |
请填空:(1)通过表格中的数值可以推断:K1随温度的升高而____________,(填增大,减小,不变),所以反应①是____________(填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g) ![]() CO(g)+H2O(g),请你写出该反应的平衡常数K3的数表达式:K3=__________,根据数据可知反应③是吸热反应。
CO(g)+H2O(g),请你写出该反应的平衡常数K3的数表达式:K3=__________,根据数据可知反应③是吸热反应。
(3)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有___(填写字母序号,下同)。
A.增大压强(压缩容器体积)
B.体积不变时充入稀有气体
C.升高温度
D.使用合适的催化剂
(4)图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:

①图甲中t2时刻发生改变的条件可能是_____________ 、____________。
②图乙中t2时刻发生改变的条件可能是__________。
A.升高温度 B.降低温度 C.加入催化剂 D.增大压强 E.减小压强 F.充入CO2 G.分离出部分CO