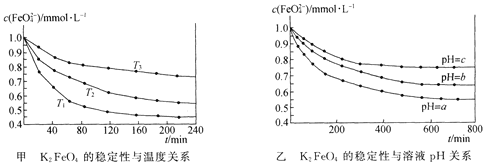
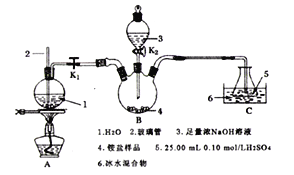
题目内容
【题目】实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),过程如下:
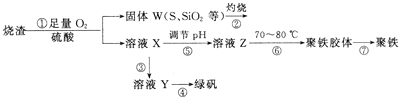
(1)将过程②中产生的气体通入下列溶液中,溶液不会褪色的是_____(填标号)。
A.品红溶液 B.紫色石蕊溶液 C.酸性KMnO4溶液 D.溴水
(2)过程①中,FeS和O2、H2SO4反应的离子方程式为_________。
(3)过程③中,需加入的物质是__________。
(4)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取2. 800 g样品;②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;③过滤、洗涤、干燥,称量,得固体质量为3. 495 g。若该聚铁主要成分为[Fe(OH) (SO4)]n,则该聚铁样品中铁元素的质量分数为____________(假设杂质中不含铁元素和硫元素)。
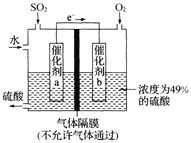
(5)如图是将过程②产生的气体SO2转化为重要的化工原料H2SO4的原理示意图,若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为______。
【答案】B 4 FeS+3O2+12 H+=== 4Fe3++6H2O+4S Fe(或铁) 30% 8 : 15
【解析】
过程②产生的气体为![]() ,具有还原性和漂白性;根据反应物和生成物的种类结合质量守恒书写化学方程式;溶液X中含有
,具有还原性和漂白性;根据反应物和生成物的种类结合质量守恒书写化学方程式;溶液X中含有![]() ,要制备绿矾,应加入
,要制备绿矾,应加入![]() 使之还原为
使之还原为![]() ;
;
(1)过程②产生的气体为![]() ,具有还原性和漂白性,因具有漂白性而使品红褪色,因具有还原性而使具有氧化性的酸性
,具有还原性和漂白性,因具有漂白性而使品红褪色,因具有还原性而使具有氧化性的酸性![]() 溶液、溴水褪色,只有紫色石蕊试液不会褪色。
溶液、溴水褪色,只有紫色石蕊试液不会褪色。
故答案为:B;
(2)反应物为![]() 、
、![]() 和
和![]() ,生成物有
,生成物有![]() ,根据质量守恒还应有
,根据质量守恒还应有![]() 和
和![]() ,反应的离子方程式为
,反应的离子方程式为![]() ,
,
故答案为:![]() ;
;
(3)溶液X中含有![]() ,要制备绿矾,应加入
,要制备绿矾,应加入![]() 使之还原为
使之还原为![]() ,加入铁可生成
,加入铁可生成![]() ,并且不引入新的杂质,
,并且不引入新的杂质,
故答案为:Fe(或铁);
(4)过滤、洗涤、干燥,称量,得固体质量为3.495g,应为BaSO4沉淀,![]() ,则
,则![]() ,
,![]() ,该聚铁样品中铁元素的质量分数
,该聚铁样品中铁元素的质量分数![]() ,
,
故答案为:30%
(5)原硫酸浓度为49%,得到的硫酸浓度仍为49%,所以新生成的硫酸的质量比后加入物质的总质量为49%,总方程式为:![]() ,加入
,加入![]() 的质量为x g,加入水的质量为y g,需要通入氧气的质量为:
的质量为x g,加入水的质量为y g,需要通入氧气的质量为:![]() g,新生成硫酸的质量为
g,新生成硫酸的质量为![]() g,故
g,故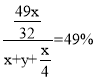 ,解得
,解得![]() ,
,
故答案为:8 : 15。

【题目】现有A、B、C、D、E五种短周期元素,已知A、B、C、D四种元素的核内质子数之和为56,在元素周期表中的位置如图所示,1 mol E的单质可与足量酸反应,能产生33.6 L H2(在标准状况下);E的阳离子与A的阴离子核外电子层结构相同。
A | ||
B | C | D |
回答下列问题:
(1)写出下列元素名称A__________,B___________,E____________
(2)C的简单离子结构示意图为_____________
(3)B单质在A单质中燃烧,反应现象是__________________________________,生成物的化学式为___________
(4)A与E形成的化合物的化学式为__________,它的性质决定了它在物质的分类中应属于__________________
(5)向D与E形成的化合物的水溶液中滴入烧碱溶液至过量,此过程中观察到的现象是_______________________,写出有关化学反应方程式______________________________。