题目内容
17.在具有活塞的密闭容器中,一定温度下的可逆反应,H2(g)+I2(g)?2HI(g)已达平衡,将活塞外拉,在此过程中:(1)容器颜色变浅(填“变浅”或“变深”).
(2)容器内的压强变小 (填“变大”“变小”或“不变”).
(3)混合气体的密度变小(填“变大”“变小”或“不变”).
分析 一定温度下的可逆反应,H2(g)+I2(g)?2HI(g)已达平衡,将活塞外拉,则体积增大,压强变小,根据碘单质的浓度判断容器颜色,根据ρ=$\frac{m}{V}$判断混合气体的密度判断.
解答 解:(1)一定温度下的可逆反应,H2(g)+I2(g)?2HI(g)已达平衡,将活塞外拉,则体积增大,压强变小,虽然平衡不移动,但体积增大碘单质的浓度减小,则容器颜色变浅,故答案为:变浅;
(2)将活塞外拉,则体积增大,压强变小,故答案为:变小;
(3)将活塞外拉,则体积增大,压强变小,总质量不变,根据ρ=$\frac{m}{V}$,则混合气体的密度变小,故答案为:变小.
点评 本题考查了化学平衡影响因素分析判断,平衡移动原理和反应特征是解题关键,注意反应特征和平衡移动原理的理解应用,题目较简单.

练习册系列答案
相关题目
5.下列各组离子,在溶液中能大量共存加入NaOH溶液后有沉淀生成的一组是( )
| A. | Fe2+、Ba2+、NO3-、ClO- | B. | Ba2+、NH4+、HCO3-、K+ | ||
| C. | K+、Fe3+、Ba2+、HSO3- | D. | Ca2+、HSO3-、HCO3-、AlO${\;}_{2}^{-}$ |
8.对于任何一个平衡体系,采用下列措施一定会使平衡移动的是( )
| A. | 增大反应物用量 | B. | 使用催化剂 | C. | 增大体系压强 | D. | 升高温度 |
5.密闭容器中存在反应:CO(g)+H2O(g)?CO2(g)+H2(g),当充入1mol CO和1mol水蒸气,达到平衡时生成了0.67molCO2,当充入的水蒸气改为4mol,其它条件不变,平衡时生成的CO2的物质的量可能为( )
| A. | 0.5 mol | B. | 0.95 mol | C. | 0.67 mol | D. | 1 mol |
12.下列离子方程式正确的是( )
| A. | Ca(HCO3)2溶液中加入过量NaOH溶液Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| B. | SO2通入溴水中SO2+Br2+2H2O═4H++2Br-+SO42- | |
| C. | 泡沫灭火器原理:2Al3++3CO32-+3H2O═2Al(OH)3↓+3CO2↑ | |
| D. | FeO与稀HNO3反应FeO+2H+═Fe2++H2O |
9.下列有关化学与生活的说法不正确的是( )
| A. | 采用原煤脱硫技术,可减少燃煤产生的SO2 | |
| B. | 晶体硅可以制作太阳能电池板 | |
| C. | 自来水厂可用氯气来杀菌消毒,因此氯气无毒 | |
| D. | 分散系中分散质粒子的直径:Fe(OH)3 悬浊液>Fe(OH)3 胶体>FeCl3 溶液 |
6.下列反应中属于氧化还原反应,但水既不是氧化剂,又不是还原剂的是( )
| A. | 2F2+2H2O═4HF+O2 | B. | H2O+CO2═H2CO3 | ||
| C. | Cl2+H2O═HClO+HCl | D. | 2H2O═2H2↑+O2↑ |
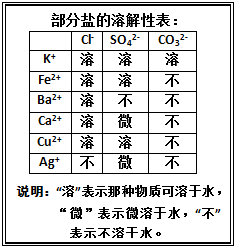 某混合物澄清透明的水溶液中,可能含有以下离子中若干种:K+、Ca2+、Fe2+、Cu2+、Cl-、CO32-、SO42-,现每次取该溶液100.00ml溶液进行以下实验:
某混合物澄清透明的水溶液中,可能含有以下离子中若干种:K+、Ca2+、Fe2+、Cu2+、Cl-、CO32-、SO42-,现每次取该溶液100.00ml溶液进行以下实验: