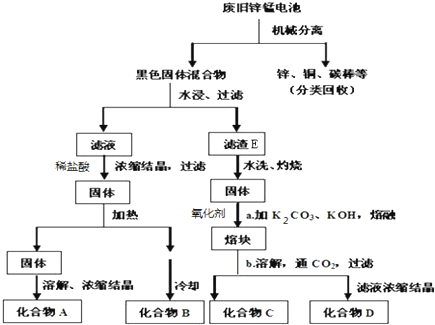
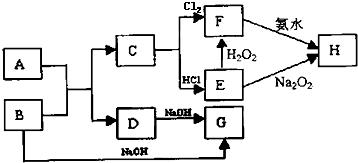
题目内容
14.0.1mol Na2SO4溶解在( )mol H2O中,才能使100个H2O中含1个Na+.| A. | 20 mol | B. | 10 mol | C. | 5 mol | D. | 30 mol |
分析 0.1molNa2SO4溶解在水中电离出0.2molNa+,由N=nNA可知,个数之比等于物质的量之比,以此来解答.
解答 解:.1molNa2SO4溶解在水中电离出0.2molNa+,由N=nNA可知,个数之比等于物质的量之比,
设水的物质的量为x,则
$\frac{1}{100}=\frac{0.2}{x}$,解得x=20mol,
故选A.
点评 本题考查物质的量的计算,为高频考点,把握物质的量与微粒个数的关系、物质的电离为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
5.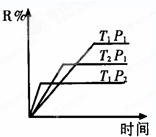 在密闭容器中进行下列反应:M(气)+N(气)?R(气)+2A此反应符合下面图象,(纵坐标为R的质量百分含量)下列叙述正确的是( )
在密闭容器中进行下列反应:M(气)+N(气)?R(气)+2A此反应符合下面图象,(纵坐标为R的质量百分含量)下列叙述正确的是( )
 在密闭容器中进行下列反应:M(气)+N(气)?R(气)+2A此反应符合下面图象,(纵坐标为R的质量百分含量)下列叙述正确的是( )
在密闭容器中进行下列反应:M(气)+N(气)?R(气)+2A此反应符合下面图象,(纵坐标为R的质量百分含量)下列叙述正确的是( )| A. | 正反应吸热,A是气体 | B. | 正反应吸热,A是固体 | ||
| C. | 正反应放热,A是气体 | D. | 正反应放热,A是固体或液体 |
6.设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
| A. | 28 g乙烯和28g丙烯中均含有6NA对共用电子对 | |
| B. | 标准状况下,2.24L氯仿中含有C-Cl数目为0.3NA | |
| C. | 标准状况下,560 mL甲烷和甲醛的混合气体中,含有的共用电子对数为0.2NA | |
| D. | 11.2L乙烯、乙炔的混合物中C原子数为NA |
3.下列各项中,主要属于化学科学研究范畴的是( )
| A. | 许多金属和合金具有低温下失去电阻的特性,即具有超导性 | |
| B. | 两个较轻的原子核聚合为一个较重的原子核时要释放出大量的能量,所释放的能量可用于发电 | |
| C. | 天然的、人为的各种电磁波干扰和有害的电磁辐射会造成电磁污染 | |
| D. | 美国科学家利用分子组装技术研制出世界上最小的“纳米算盘”,该算盘的算珠由球形C60分子构成 |
4.下列说法正确的是:( )
| A. | 2014年1月4日,国家首次将雾霾天气纳入自然灾情进行通报.雾霾也是一种分散系,分散剂为空气 | |
| B. | 氯化氢溶于水的过程中虽然有H-Cl键的断裂,但没有新化学键的形成,所以该过程是物理过程 | |
| C. | 2014年12月某市某化工市场发生爆炸,据调查为化工原料“醋酸乙烯”燃烧所致,该化工原料属于烯烃 | |
| D. | 2014年的诺贝尔化学奖授予了超高分辨率荧光显微镜的发展者,该技术突破了光学显微镜的极限,能观察到纳米尺度的微粒,该技术还可以将研究反应速率的时间分辨率达到纳秒级水平 |

 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示: