题目内容
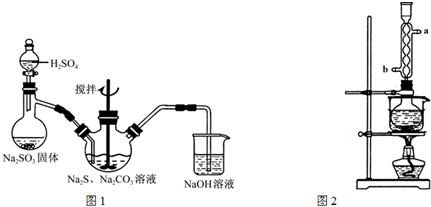
4.工业制钛白粉产生的废液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4,可利用酸解法生产补血剂乳酸亚铁.其生产流程如图1:
已知:TiOSO4可溶于水,在水中电离为TiO2+和SO42-.请回答下列问题:
(1)写出TiOSO4水解生成钛酸H4TiO4的离子方程式TiO2++3H2O═H4TiO4+2H+(.步骤①中加入足量铁屑的目的是将溶液中的Fe3+还原为Fe2+,消耗溶液中的H+促进TiO2+水解.
(2)工业上由H4TiO4可制得钛白粉TiO2.TiO2直接电解还原法(剑桥法)生产钛是一种较先进的方法,电解质为熔融的CaCl2,原理如图2所示,阴极的电极反应为TiO2+4e-═Ti+2O2-.
(3)步骤②的离子方程式是Fe2++2HCO3-═FeCO3↓+CO2↑+H2O,所得副产品主要是(NH4)2SO4(填化学式).
(4)步骤④的结晶过程中必须控制一定的真空度,原因是防止Fe2+被空气中的氧气氧化.
(5)乳酸可由乙烯经下列步骤合成:
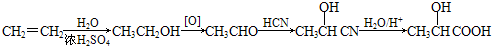
酸与碳酸亚铁反应转化为乳酸亚铁晶体的产率为90%,则生产468kg乳酸亚铁晶体(M=234g/mol)需要标准状况下的乙烯99.6m3.
分析 (1)TiOSO4水解实际上是TiO2+水解;加入铁粉能将Fe3+还原为Fe2+,消耗溶液中的H+促进TiO2+水解;
(2)阴极上得电子发生还原反应;
(3)由流程图可知,硫酸亚铁与碳酸氢铵反应是碳酸亚铁,还生成气体为二氧化碳,溶液B为硫酸铵溶液;
(4)亚铁离子易被氧气氧化;
(5)根据乳酸生成乳酸亚铁的物质的量之比为2:1,设需要的乙烯的体积为Xm3,根据乙烯和乳酸之间的转化关系列式计算即可.
解答 解:(1)TiOSO4水解实际上是TiO2+水解,即TiO2+和水反应生成钛酸H4TiO4,根据质量守恒可知水解的离子方程式为:TiO2++3H2O═H4TiO4+2H+;加入铁粉能将Fe3+还原为Fe2+,且由于TiO2+是弱碱阳离子,铁粉的加入能消耗溶液中的H+促进TiO2+水解;
故答案为:TiO2++3H2O═H4TiO4+2H+;将溶液中的Fe3+还原为Fe2+,消耗溶液中的H+促进TiO2+水解;
(2)电解时,阴极上得电子发生还原反应,所以二氧化钛得电子生成钛和氧离子,和电源负极相连,电极反应式为TiO2+4e-=Ti+2O2-;
故答案为:TiO2+4e-=Ti+2O2-;
(3)由流程图可知,硫酸亚铁与碳酸氢铵反应是碳酸亚铁,还生成气体为二氧化碳,副产品为硫酸铵溶液,反应离子方程式为:Fe2++2HCO3-=FeCO3↓+H2O+CO2↑,故答案为:Fe2++2HCO3-=FeCO3↓+H2O+CO2↑; (NH4)2SO4;
(4)亚铁离子易被氧气氧化,所以步骤⑥必须控制一定的真空度,这样有利于蒸发水还能防止Fe2+被氧化,故答案为:防止Fe2+被氧化;
(5)根据乳酸生成乳酸亚铁的物质的量之比为2:1,设需要的乙烯的体积为Xm3,由于乳酸与碳酸亚铁反应转化为乳酸亚铁晶体的产率为90%,则生成468Kg乳酸亚铁所需的乙烯的量之间有:$\frac{1000xL}{22.4L/mol}×\frac{1}{2}$=$\frac{\frac{468000g}{234g/mol}}{0.9}$,解得x=99.6,故答案为:99.6.
点评 本题综合考查物质性质、电极反应的书写等,要求学生具有一定分析和解决问题的能力,题目难度中等.

| A. | Ag+、NO3-、Cl-、K+ | B. | Cu2+、NH4+、Br-、OH- | ||
| C. | H+、NO3-、Fe2+、Na+ | D. | K+、Ba2+、OH-、SO42- |
①O-H…O ②N-H…N ③F-H…F ④O-H…N.
| A. | ③>①>④>② | B. | ①>②>③>④ | C. | ③>②>①>④ | D. | ①>④>③>② |
| A. | 20 mol | B. | 10 mol | C. | 5 mol | D. | 30 mol |