题目内容
某实验小组欲通过以下实验来探究Na2CO3和NaHCO3两种物质的性质.
(1)称取两种固体各2g,分别放入两个小烧杯中,再各滴加10mL蒸馏水,振荡,测量温度变化;待固体充分溶解,并恢复至室温后,向所得溶液中各滴入2滴酚酞试液.
①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得到结论 .
②同学们在两烧杯中还观察到了其它现象.其中,盛放Na2CO3的烧杯中出现的现象是 (填字母序号).
A.溶液温度下降 B.溶液温度升高
C.滴入酚酞后呈浅红色 D.滴入酚酞后呈红色
(2)如图甲所示分别加热A、B固体,发现固体A受热产生的气体能使澄清石灰水变浑浊,但一段时间后浑浊又变澄清.请用化学方程式解释澄清石灰水中发生的现象 .
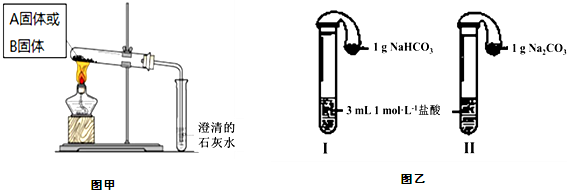
(3)如图乙所示,在气密性良好的装置I和Ⅱ中分别放入试剂,将气球内的固体同时倒入试管中.
①两试管中均产生气体, (填“Ⅰ”或“Ⅱ”)的反应程度更为剧烈.
②反应结束后,气球均有膨胀,恢复至室温.下列说法正确的是 .
A.装置I的气球体积较大 B.装置Ⅱ的气球体积较大
C.生成气体的体积根据盐酸计算 D.生成气体的体积根据固体计算
(4)将两种固体分别配制成0.5mol?L-1的溶液,探究与0.5mol?L-1 CaCl2溶液反应的情况
请写出上述实验过程中发生的反应的离子方程式:
实验1: ; 实验2: .
(1)称取两种固体各2g,分别放入两个小烧杯中,再各滴加10mL蒸馏水,振荡,测量温度变化;待固体充分溶解,并恢复至室温后,向所得溶液中各滴入2滴酚酞试液.
①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得到结论
②同学们在两烧杯中还观察到了其它现象.其中,盛放Na2CO3的烧杯中出现的现象是
A.溶液温度下降 B.溶液温度升高
C.滴入酚酞后呈浅红色 D.滴入酚酞后呈红色
(2)如图甲所示分别加热A、B固体,发现固体A受热产生的气体能使澄清石灰水变浑浊,但一段时间后浑浊又变澄清.请用化学方程式解释澄清石灰水中发生的现象

(3)如图乙所示,在气密性良好的装置I和Ⅱ中分别放入试剂,将气球内的固体同时倒入试管中.
①两试管中均产生气体,
②反应结束后,气球均有膨胀,恢复至室温.下列说法正确的是
A.装置I的气球体积较大 B.装置Ⅱ的气球体积较大
C.生成气体的体积根据盐酸计算 D.生成气体的体积根据固体计算
(4)将两种固体分别配制成0.5mol?L-1的溶液,探究与0.5mol?L-1 CaCl2溶液反应的情况
| 实验方案 | 预测现象 | 预测依据 | 实际结果 |
| 实验1:向2mL Na2CO3溶液中滴加1mL 0.5mol?L-1 CaCl2溶液 | 有白色 沉淀 | Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应 | 有白色沉淀 |
| 实验2:向2mL NaHCO3溶液中滴加1mL 0.5mol?L-1 CaCl2溶液 | 无白色 沉淀 | NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应 | 有白色沉淀出现,同时有少量气泡冒出. |
实验1:
考点:探究碳酸钠与碳酸氢钠的性质
专题:常规题型,实验题,元素及其化合物
分析:(1)①常温下,同质量、同体积的溶剂,Na2CO3固体完全溶解,而NaHCO3固体有剩余,说明Na2CO3较NaHCO3易溶;
②碳酸钠为强碱弱酸盐,水解吸热,溶液呈碱性;
(2)碳酸钠热稳定性差,受热易分解,生成二氧化碳气体,二氧化碳和氢氧化钙反应生成碳酸钙沉淀,碳酸钙和二氧化碳和水反应生成可溶的碳酸氢钙;
(3)①同等条件下,碳酸钠与盐酸反应速率不及碳酸氢钠与盐酸反应;②等质量的Na2CO3和NaHCO3,NaHCO3物质的量较多,生成二氧化碳多;
(4)碳酸钠能和氯化钙反应生成碳酸钙沉淀和氯化钠;CaCl2与NaHCO3溶液反应生成碳酸钙沉淀和二氧化碳气体;
②碳酸钠为强碱弱酸盐,水解吸热,溶液呈碱性;
(2)碳酸钠热稳定性差,受热易分解,生成二氧化碳气体,二氧化碳和氢氧化钙反应生成碳酸钙沉淀,碳酸钙和二氧化碳和水反应生成可溶的碳酸氢钙;
(3)①同等条件下,碳酸钠与盐酸反应速率不及碳酸氢钠与盐酸反应;②等质量的Na2CO3和NaHCO3,NaHCO3物质的量较多,生成二氧化碳多;
(4)碳酸钠能和氯化钙反应生成碳酸钙沉淀和氯化钠;CaCl2与NaHCO3溶液反应生成碳酸钙沉淀和二氧化碳气体;
解答:
解:(1)①称取两种固体各2g,分别放入两个小烧杯中,再各滴加10mL蒸馏水,振荡,测量温度变化;待固体充分溶解,并恢复至室温后,发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,说明在同样的温度下,同质量的两种固体在同体积的溶剂中,Na2CO3比NaHCO3易溶于水,
故答案为:同温度下,Na2CO3比NaHCO3易溶于水;
②A.碳酸钠为强碱弱酸盐,水解吸热溶液温度下降,故A正确;
B.水解吸热溶液温度下降,故B错误;
C.碳酸钠为强碱弱酸盐,水解溶液呈碱性,滴入酚酞后呈红色,故C错误;
D.碳酸钠为强碱弱酸盐,水解溶液呈碱性,碳酸钠俗称纯碱,滴入酚酞后呈红色,故D正确;
故答案为:A、D;
(2)碳酸氢钠受热易分解,2NaHCO3
Na2CO3+CO2↑+H2O,生成的CO2气体通入澄清石灰水中发生反应,CO2+Ca(OH)2=CaCO3↓+H2O 生成碳酸钙沉淀变浑浊,碳酸钙和二氧化碳和水反应生成可溶的碳酸氢钙:CaCO3+CO2+H2O=Ca(HCO3)2,所以一段时间后浑浊又变澄清,
故答案为:Ca(OH)2+CO2=CaCO3↓+H2O; CaCO3+CO2+H2O=Ca(HCO3)2;
(3)①将气球内的固体同时倒入试管发生反应:Na2CO3+2HCl═2NaCl+H2O+CO2↑,NaHCO3+HCl═NaCl+H2O+CO2↑,同等条件下,碳酸钠与盐酸反应速率不及碳酸氢钠与盐酸反应,所以I的反应程度更为剧烈,
故答案为:Ⅰ;
②Na2CO3的摩尔质量为:106g/mol;NaHCO3的摩尔质量为:84g/mol,等质量的Na2CO3和NaHCO3,NaHCO3物质的量较多,生成二氧化碳多,所以装置I的气球体积较大,Na2CO3+2HCl═2NaCl+H2O+CO2↑,NaHCO3+HCl═NaCl+H2O+CO2↑,生成气体的体积可根据盐酸计算,
故答案为:A、C;
(4)实验1:碳酸钠能和氯化钙反应CaCl2+Na2CO3═CaCO3↓+2NaCl,离子反应为:Ca2++CO32-=CaCO3↓,
故答案为:Ca2++CO32-=CaCO3↓;
实验2:CaCl2与NaHCO3溶液可发生反应:CaCl2+2NaHCO3=CaCO3↓+2NaCl+CO2↑+H2O,离子反应为:Ca2++2HCO3-=CaCO3↓+CO2↑+H2O,
故答案为:Ca2++2HCO3-=CaCO3↓+CO2↑+H2O;
故答案为:同温度下,Na2CO3比NaHCO3易溶于水;
②A.碳酸钠为强碱弱酸盐,水解吸热溶液温度下降,故A正确;
B.水解吸热溶液温度下降,故B错误;
C.碳酸钠为强碱弱酸盐,水解溶液呈碱性,滴入酚酞后呈红色,故C错误;
D.碳酸钠为强碱弱酸盐,水解溶液呈碱性,碳酸钠俗称纯碱,滴入酚酞后呈红色,故D正确;
故答案为:A、D;
(2)碳酸氢钠受热易分解,2NaHCO3
| ||
故答案为:Ca(OH)2+CO2=CaCO3↓+H2O; CaCO3+CO2+H2O=Ca(HCO3)2;
(3)①将气球内的固体同时倒入试管发生反应:Na2CO3+2HCl═2NaCl+H2O+CO2↑,NaHCO3+HCl═NaCl+H2O+CO2↑,同等条件下,碳酸钠与盐酸反应速率不及碳酸氢钠与盐酸反应,所以I的反应程度更为剧烈,
故答案为:Ⅰ;
②Na2CO3的摩尔质量为:106g/mol;NaHCO3的摩尔质量为:84g/mol,等质量的Na2CO3和NaHCO3,NaHCO3物质的量较多,生成二氧化碳多,所以装置I的气球体积较大,Na2CO3+2HCl═2NaCl+H2O+CO2↑,NaHCO3+HCl═NaCl+H2O+CO2↑,生成气体的体积可根据盐酸计算,
故答案为:A、C;
(4)实验1:碳酸钠能和氯化钙反应CaCl2+Na2CO3═CaCO3↓+2NaCl,离子反应为:Ca2++CO32-=CaCO3↓,
故答案为:Ca2++CO32-=CaCO3↓;
实验2:CaCl2与NaHCO3溶液可发生反应:CaCl2+2NaHCO3=CaCO3↓+2NaCl+CO2↑+H2O,离子反应为:Ca2++2HCO3-=CaCO3↓+CO2↑+H2O,
故答案为:Ca2++2HCO3-=CaCO3↓+CO2↑+H2O;
点评:本题考查Na2CO3和NaHCO3性质的异同,题目难度中等,注意把握Na2CO3和NaHCO3性质以及相关反应的方程式的书写,易错点为(4),注意CaCl2与NaHCO3溶液可发生反应:CaCl2+2NaHCO3=CaCO3↓+2NaCl+CO2↑+H2O.

练习册系列答案
相关题目
若阿伏加德罗常数的值为6.02×1023,则下列叙述正确的是( )
| A、标准状况下,2.24L戊烷中含有2.408×1023个碳碳单键 |
| B、100mL 1mol/L 的Na2CO3溶液中含有6.02×1022个CO32- |
| C、1mol氨气与1mol NH4+中所电子数均为6.02×1024 |
| D、将3.9g Na2O2放入足量的水中,反应时转移6.02×1022个电子 |
用惰性电极电解100mL 4mol?L-1的CuSO4溶液,一定时间后在阳极收集到1.12L气体,向电解后的溶液中加入足量的铁粉,充分作用后溶液中的Fe2+浓度为(设溶液的体积不变,反应前后均为标准状况)( )
| A、2.7mol?L-1 |
| B、3mol?L-1 |
| C、4mol?L-1 |
| D、1mol?L-1 |
 +3H2
+3H2