题目内容
常温下将20.0g质量分数为14.0%的NaCl溶液与30.0g质量分数为24.0%的NaCl溶液混合,得到密度为1.15g/cm3的混合溶液.计算:(1)该溶液的物质的量浓度.
(2)在1000g水中需溶入多少摩尔NaCl,才能使其物质的量浓度恰好与上述混合溶液的物质的量浓度相等.
(2)在1000g水中需溶入多少摩尔NaCl,才能使其物质的量浓度恰好与上述混合溶液的物质的量浓度相等.
考点:物质的量浓度的相关计算
专题:物质的量浓度和溶解度专题
分析:(1)根据V=
计算溶液的体积,再c=
计算出混合后溶液的物质的量浓度;
(3)根据ω=
计算混合后溶液的质量分数,设需要NaCl的物质的量为xmol,根据质量分数列方程计算.
| m溶液 |
| ρ |
| n |
| V |
(3)根据ω=
| m溶质 |
| m溶液 |
解答:
解:(1)混合溶液的体积为:
=43.48mL=0.04348L,
溶液中溶质的物质的量为:
=0.1709mol,
混合后溶液的物质的量浓度为:
=3.93mol/L,
答:混合后溶液的物质的量浓度为3.93mol/L;
(2)混合后溶液中的质量为:20.0g+30.0g=50.0g,溶质NaCl的质量为:20.0g×14%+30.0g×24%=10.0g,混合后溶液的质量分数:
×100%=20%,
设需要NaCl的物质的量为xmol,则:
=20%
解得:x≈4.27mol,
答:在1 000g水中需溶解4.27molNaCl才能使其浓度恰好与上述混合后溶液的浓度相等.
| 50.0g |
| 1.15 g/cm3 |
溶液中溶质的物质的量为:
| 10g |
| 58.5g/mol |
混合后溶液的物质的量浓度为:
| 0.1709 mol |
| 0.04348 L |
答:混合后溶液的物质的量浓度为3.93mol/L;
(2)混合后溶液中的质量为:20.0g+30.0g=50.0g,溶质NaCl的质量为:20.0g×14%+30.0g×24%=10.0g,混合后溶液的质量分数:
| 10.0g |
| 50.0g |
设需要NaCl的物质的量为xmol,则:
| 58.5x |
| 1000+58.5x |
解得:x≈4.27mol,
答:在1 000g水中需溶解4.27molNaCl才能使其浓度恰好与上述混合后溶液的浓度相等.
点评:本题考查了物质的量浓度、溶质的质量分数的计算,试题基础性强,侧重对学生基础知识的巩固和训练,旨在考查学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
在强酸性环境中,下列各组离子能大量共存的是( )
| A、NH4+、Cl-、NO3-、Fe2+ |
| B、Fe3+、ClO-、Na+、SO42- |
| C、SO42-、Cl-、Na+、Fe3+ |
| D、SO32-、S2-、Na+、K+ |
下列关于碳酸钠和碳酸氢钠的比较中,不正确的是( )
| A、二者在水中的溶解度不同,碳酸氢钠的溶解度小于碳酸钠 |
| B、二者热稳定性不同,碳酸钠的热稳定性大于碳酸氢钠 |
| C、二者都能与盐酸反应放出二氧化碳气体,等质量时生成CO2量一样多 |
| D、二者在一定条件下可以相互转化 |
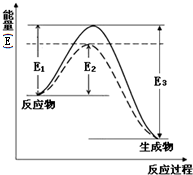 利用氮气、氢气在一定条件下生成氨气这一可逆反应来合成氨,是一个重要的化工反应.常用来生产液氨和氨水.完成下列填空:
利用氮气、氢气在一定条件下生成氨气这一可逆反应来合成氨,是一个重要的化工反应.常用来生产液氨和氨水.完成下列填空:
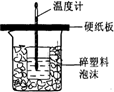 中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量.某学生想通过测定反应过程中所放出的热量来计算中和热.他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题:
中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量.某学生想通过测定反应过程中所放出的热量来计算中和热.他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题: