题目内容
若阿伏加德罗常数的值为6.02×1023,则下列叙述正确的是( )
| A、标准状况下,2.24L戊烷中含有2.408×1023个碳碳单键 |
| B、100mL 1mol/L 的Na2CO3溶液中含有6.02×1022个CO32- |
| C、1mol氨气与1mol NH4+中所电子数均为6.02×1024 |
| D、将3.9g Na2O2放入足量的水中,反应时转移6.02×1022个电子 |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.标准状况下,戊烷为液体,不能使用标况下的气体摩尔体积计算戊烷的物质的量;
B.碳酸钠溶液中,碳酸根离子部分水解,溶液中碳酸根离子数目减少;
C.氨气和铵根离子中都含有10个电子,1mol中都含有10mol电子;
D.过氧化钠中氧元素的化合价为-1价,根据过氧化钠生成氧气的物质的量计算出转移的电子数目.
B.碳酸钠溶液中,碳酸根离子部分水解,溶液中碳酸根离子数目减少;
C.氨气和铵根离子中都含有10个电子,1mol中都含有10mol电子;
D.过氧化钠中氧元素的化合价为-1价,根据过氧化钠生成氧气的物质的量计算出转移的电子数目.
解答:
解:A.标况下,戊烷不是气体,题中条件无法计算2.24L戊烷的物质的量,故A错误;
B.100mL 1mol/L 的Na2CO3溶液中含有溶质碳酸钠0.1mol,由于碳酸根离子部分水解,溶液中碳酸根离子小于0.1mol,含有的碳酸根离子数目小于含有6.02×1022,故B错误;
C.1mol氨气和1mol铵根离子中都含有10mol电子,所含电子数均为电子数均为6.02×1024,故C正确;
D.3.9g过氧化钠的物质的量为0.05mol,0.05mol过氧化钠与足量水反应生成0.025mol氧气,转移了0.05mol电子,转移了3.01×1022个电子,故D错误;
故选C.
B.100mL 1mol/L 的Na2CO3溶液中含有溶质碳酸钠0.1mol,由于碳酸根离子部分水解,溶液中碳酸根离子小于0.1mol,含有的碳酸根离子数目小于含有6.02×1022,故B错误;
C.1mol氨气和1mol铵根离子中都含有10mol电子,所含电子数均为电子数均为6.02×1024,故C正确;
D.3.9g过氧化钠的物质的量为0.05mol,0.05mol过氧化钠与足量水反应生成0.025mol氧气,转移了0.05mol电子,转移了3.01×1022个电子,故D错误;
故选C.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标准状况下四氯化碳、戊烷、水等不是气体,不能使用标况下的气体摩尔体积计算其物质的量,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,选项B为易错点,注意碳酸钠溶液中碳酸根离子部分水解.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案
相关题目
下列说法正确的是( )
| A、用量筒量取硝酸的体积时,俯视读数偏大 |
| B、海带中碘元素提取时氧化滤液中的I-时应加入过量氯水 |
| C、检验火柴头中的氯元素,可把燃尽的火柴头浸泡在少量水中,片刻后取少量溶液于试管中,加亚硝酸钠、AgNO3溶液和稀硝酸 |
| D、金属钾、钠和白磷等暴露在空气中易燃烧,所以金属钾、钠和白磷应保存在煤油中 |
在强酸性环境中,下列各组离子能大量共存的是( )
| A、NH4+、Cl-、NO3-、Fe2+ |
| B、Fe3+、ClO-、Na+、SO42- |
| C、SO42-、Cl-、Na+、Fe3+ |
| D、SO32-、S2-、Na+、K+ |
据媒体报道,美国科学家开发出一种新型锂离子电池,这种新型的超薄可充电电池可以制作在一张纸上,将碳纳米管和锂纳米线固定在纸上做两极,该电池的工作原理为:xLi+C(碳纳米管)
LixC.下列说法正确的是( )
| 放电 |
| 充电 |
| A、该电池放电时将电能转变为化学能 |
| B、该电池放电时,电子通过外电路从正极流向负极 |
| C、该电池充电时将电池的碳纳米管与外接电源的正极相连 |
| D、该电池放电时,电池的负极反应为:LixC-xe-═xLi++C |
下列说法不正确的是( )
| A、根据物质的导电性,将物质分为导体、半导体和绝缘体 |
| B、复分解反应一定不属于氧化还原反应 |
| C、实验室可用丁达尔效应区分胶体与溶液 |
| D、在水溶液中或熔融状态下能导电的物质叫做电解质 |
 19世纪丹麦学者尤利乌斯?托姆森得到一个计算CuCl2?2H2O在水中溶解热效应(设为△H,且当△H<0,放热;△H>0吸热)的式子,当所得溶液中1mol CuCl2有x mol水时,所产生的热效应△H=[3.35-21.02×
19世纪丹麦学者尤利乌斯?托姆森得到一个计算CuCl2?2H2O在水中溶解热效应(设为△H,且当△H<0,放热;△H>0吸热)的式子,当所得溶液中1mol CuCl2有x mol水时,所产生的热效应△H=[3.35-21.02×| (x-10) |
| x+11.24 |
| A、仅根据题中信息,无法计算出20℃时CuCl2饱和溶液的物质的量浓度 |
| B、当x<10,因CuCl2不能完全溶解,上图无物理意义 |
| C、在极稀的溶液中,1 mol CuCl2溶液时约放出17.67kJ热量 |
| D、CuCl2?2H2O溶于水是放热的 |
下列关于碳酸钠和碳酸氢钠的比较中,不正确的是( )
| A、二者在水中的溶解度不同,碳酸氢钠的溶解度小于碳酸钠 |
| B、二者热稳定性不同,碳酸钠的热稳定性大于碳酸氢钠 |
| C、二者都能与盐酸反应放出二氧化碳气体,等质量时生成CO2量一样多 |
| D、二者在一定条件下可以相互转化 |
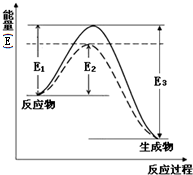 利用氮气、氢气在一定条件下生成氨气这一可逆反应来合成氨,是一个重要的化工反应.常用来生产液氨和氨水.完成下列填空:
利用氮气、氢气在一定条件下生成氨气这一可逆反应来合成氨,是一个重要的化工反应.常用来生产液氨和氨水.完成下列填空: