题目内容
10.现有下列短周期元素相关性质的数据:| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 |
| 最高正化合价 | +2 | +1 | +5 | +7 | +1 | +5 | |
| 最低负化合价 | -2 | -3 | -1 | -3 |
(1)元素⑤在周期表中的位置第三周期ⅦA族;
(2)元素④与元素⑦相比较,气态氢化物较稳定的是
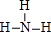 (填结构式);
(填结构式);(3)元素④形成的+3和+5价的氯化物中,各原子均达到8电子稳定结构的化合物是PCl3(写化学式);
(4)以下叙述正确的是A.
A.氢化物的沸点为④<⑦B.①与②形成的化合物具有两性
C.与稀盐酸反应单质②比单质⑥快 D.最高价氧化物对应水化物的碱性③>⑥
分析 ①只有最低价-2价,则①为O;⑤有+7、-1价,处于ⅦA族,为Cl元素;④⑦有+5、-3价,处于ⅤA族,且④原子半径较大,则④为P、⑦为N;③⑥只有最高正价+1价,处于ⅠA族,且⑥的原子半径较大,③原子半径不是最小,则③为Li、⑥为Na;②最高价+2价,处于ⅡA族,原子半径大于P,则②为Mg,据此解答.
解答 解:①只有最低价-2价,则①为O;⑤有+7、-1价,处于ⅦA族,为Cl元素;④⑦有+5、-3价,处于ⅤA族,且④原子半径较大,则④为P、⑦为N;③⑥只有最高正价+1价,处于ⅠA族,且⑥的原子半径较大,③原子半径不是最小,则③为Li、⑥为Na;②最高价+2价,处于ⅡA族,原子半径大于P,则②为Mg.
(1)元素⑤为Cl元素,在周期表中的位置:第三周期ⅦA族,故答案为:第三周期ⅦA族;
(2)元素非金属性N>P,故NH3较稳定,结构式为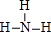 ,故答案为:
,故答案为: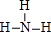 ;
;
(3)元素④为P元素,形成的+3和+5价的氯化物中,各原子均达到8电子稳定结构的化合物是PCl3,故答案为:PCl3;
(4)A.氨气分子之间存在氢键,沸点高于PH3,故A正确;
B.①与②形成的化合物为MgO,不具有两性,故B错误;
C.金属性Mg<Na,故Na与稀盐酸更快,故C错误;
D.金属性Li<Na,故NaOH的碱性强于LiOH,故D错误,
故选:A.
点评 本题考查性质结构位置关系应用,根据化合价与原子半径推断元素是解题的关键,注意掌握元素周期律,难度中等.

练习册系列答案
相关题目
1.以下各项中的物质,互为同分异构体的是( )
| A. | CO和CO2 | B. | 淀粉和纤维素 | C. | 红磷和白磷 | D. | CH3CH2CH2CH3和 |
18.一定条件密闭容器中发生如下反应:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H<0,下列有关描述中正确的是( )
| A. | 升高温度,上述反应的平衡常数增大 | |
| B. | 其他条件不变,压缩容器,V正、V逆均增大 | |
| C. | 保持容器的容积不变,向密闭容器中充入CO2,平衡逆向移动 | |
| D. | 保持体系的压强不变,向密闭容器中充入氦气,平衡正向移动 |
15.莽草酸可用于合成药物达菲,结构简式如图,关于莽草酸的说法不正确的是( )


| A. | 分子式为C7H10O5 | |
| B. | 分子中含有3种官能团 | |
| C. | 可发生加成反应和酯化反应 | |
| D. | 在水溶液中羧基和羟基均能电离出H+而使溶液显酸性 |
2.下列物质中,既含离子键又含共价键的是( )
| A. | NaCl | B. | HCl | C. | NH3 | D. | NH4Cl |
19.哈伯因发明了用氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖.现向一密闭容器中充入1molN2和3molH2,在一定条件下使该反应发生.下列说法正确的是( )
| A. | 达到化学平衡时,N2完全转化为NH3 | |
| B. | 达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 | |
| C. | 达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 | |
| D. | 达到化学平衡时,正反应和逆反应速率都为零 |
20.铅蓄电池是最常见的二次电池,其电池总反应可以表示为:Pb(s)+PbO2(s)+2H2SO4(aq)$?_{充电}^{放电}$2PbSO4(s)+2H2O(l),下列说法不正确的是( )
| A. | 电池的电解液为酸性溶液,正极为PbO2、负极为Pb | |
| B. | 电池放电时,正极反应为PbO2+2 e-+SO42-+4H+═PbSO4+2H2O | |
| C. | 电池充电过程中,阳极附近溶液的pH升高 | |
| D. | 电池充电时,阴极反应为PbSO4+2e-═Pb+SO42- |
 有aX、bY、cZ三种元素.已知:①各原子序数a、b、c均小于20且a+b+c=25;②元素Y的电子外围电子构型为nsnnpn+2;③X和Y在不同条件下可形成X2Y和X2Y2两种化合物,Y和Z在不同条件下可形成ZY和ZY2两种化合物;④Z的硫化物的相对分子质量与Z的氯化物的相对分子质量之比为38:77.据上可推知:
有aX、bY、cZ三种元素.已知:①各原子序数a、b、c均小于20且a+b+c=25;②元素Y的电子外围电子构型为nsnnpn+2;③X和Y在不同条件下可形成X2Y和X2Y2两种化合物,Y和Z在不同条件下可形成ZY和ZY2两种化合物;④Z的硫化物的相对分子质量与Z的氯化物的相对分子质量之比为38:77.据上可推知:
 .
. .
. 中任意两种.
中任意两种.