题目内容
2.下列物质中,既含离子键又含共价键的是( )| A. | NaCl | B. | HCl | C. | NH3 | D. | NH4Cl |
分析 活泼金属和活泼金属元素之间易形成离子键,非金属元素之间易形成共价键,部分碱、大多数盐、金属氧化物、铵盐中都含有离子键,据此分析解答.
解答 解:A.NaCl中钠离子和氯离子之间只存在离子键,故A错误;
B.HCl分子中H-Cl原子之间只存在共价键,故B错误;
C.氨气分子中N-H原子之间只存在共价键,故C错误;
D.氯化铵中铵根离子和氯离子之间存在离子键、N-H原子之间存在共价键,故D正确;
故选D.
点评 本题考查离子键和共价键,侧重考查基本概念,明确物质构成微粒及微粒之间作用力即可解答,注意不能根据是否含有金属元素判断离子键,易错选项是D.

练习册系列答案
相关题目
12.利用图装置电解饱和食盐水,下列说法正确的是( )


| A. | 电解质溶液中Cl-向a电极迁移 | |
| B. | 该装置能将化学能转变成电能 | |
| C. | b电极上发生氧化反应 | |
| D. | 若b为铁,则b电极的反应式为:Fe-2e-═Fe2+ |
13.下列溶液中各微粒的浓度关系正确的是( )
| A. | 0.2mol•L-1某一元弱酸HA溶液和0.1mol•L-1NaOH溶液等体积混合后的溶液:2c(OH-)+c(A-)═2c(H+)+c(HA) | |
| B. | c(NH4+)相等的(NH4)2C03、(NH4)2S04和(NH4)2Fe(S04)2三份溶液中,溶质物质的量浓度依 次增大 | |
| C. | 在 0.lmol•L-1Na2CO3溶液中:c(OH-)-c(H+)═c(HCO3-)+c(H2C03) | |
| D. | 常温下,CH3COONa和 CH3COOH 混合溶液[pH=7,c(Na+)=0.1mol•L-1];c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
10.现有下列短周期元素相关性质的数据:
试回答下列问题:
(1)元素⑤在周期表中的位置第三周期ⅦA族;
(2)元素④与元素⑦相比较,气态氢化物较稳定的是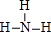 (填结构式);
(填结构式);
(3)元素④形成的+3和+5价的氯化物中,各原子均达到8电子稳定结构的化合物是PCl3(写化学式);
(4)以下叙述正确的是A.
A.氢化物的沸点为④<⑦B.①与②形成的化合物具有两性
C.与稀盐酸反应单质②比单质⑥快 D.最高价氧化物对应水化物的碱性③>⑥
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 |
| 最高正化合价 | +2 | +1 | +5 | +7 | +1 | +5 | |
| 最低负化合价 | -2 | -3 | -1 | -3 |
(1)元素⑤在周期表中的位置第三周期ⅦA族;
(2)元素④与元素⑦相比较,气态氢化物较稳定的是
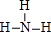 (填结构式);
(填结构式);(3)元素④形成的+3和+5价的氯化物中,各原子均达到8电子稳定结构的化合物是PCl3(写化学式);
(4)以下叙述正确的是A.
A.氢化物的沸点为④<⑦B.①与②形成的化合物具有两性
C.与稀盐酸反应单质②比单质⑥快 D.最高价氧化物对应水化物的碱性③>⑥
17.下列元素中,属于金属元素的是( )
| A. | C | B. | Cu | C. | N | D. | Ar |
7.下列元素中,属于第二周期VIA族的是( )
| A. | 钠 | B. | 氧 | C. | 氯 | D. | 硫 |
14.下列氧化物不能跟铝粉组成铝热剂的是( )
| A. | Cr2O3 | B. | MnO2 | C. | MgO | D. | V2O5 |
11.化学是社会生活联系最为紧密的学科之一,下列有关化学与生活说法错误的是( )
| A. | 利用石油中各组分沸点的不同,通过分馏的方法可以获得汽油、煤油、柴油 | |
| B. | 不加糖不等于没有糖,糖尿病人应该注意日常饮食 | |
| C. | 水果散发出诱人的香味,其主要成分是一种低级酯类物质 | |
| D. | 煤的干馏属于物理变化 |
12.下列说法正确的是( )
| A. | 分子晶体中一定存在分子间作用力,不一定存在共价键 | |
| B. | 水加热到很高的温度都难以分解于氢键有关 | |
| C. | CO2晶体是分子晶体,可推测SiO2晶体也是分子晶体 | |
| D. | HF、HCl、HBr、HI的熔沸点随着相对分子质量的增加依次升高 |