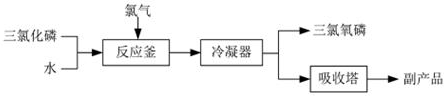
题目内容
5.实验室以氯化铁腐蚀印刷电路铜板后的溶液(简称“腐蚀废液”)为主要原料来制备氯化铁晶体,从而重新用作腐蚀印刷电路铜板的试剂.该制备流程如图: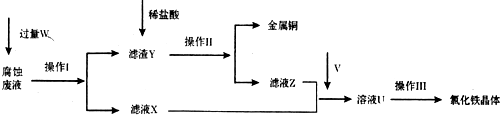
请回答下列问题:
(1)操作Ⅰ和操作Ⅱ相同,其中操作I加入的试剂W是铁粉 (填写名称),操作Ⅱ和操作Ⅲ都使用的玻璃仪器名称是玻璃棒,其中操作Ⅲ中该仪器的作用是搅拌.
(2)进行操作Ⅲ前需要通人气体V,该气体化学式是Cl2,若将溶液U加热蒸干灼烧后得到的固体物质化学式是Fe2O3.
(3)请写出实验室制取气体V的反应的离子方程式:MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O.
(4)若通人的V的量不足,则最后制得的氯化铁晶体不纯净,这是因为溶液U中含有杂质
FeCl2.请设计合理的实验,验证溶液U中的成分,并判断通入的V的量是否不足取少量溶液U,加入几滴KSCN溶液,若溶液显血红色,则表明溶液U中含有Fe3+(或FeCl3),另取少量溶液U,加入几滴酸性KMnO4溶液,若KMnO4溶液褪色,则表明溶液U中含有Fe2+(或FeCl2),说明通人V的量不足,若KMnO4溶液不褪色,说明通人V的量足够 (简要说明实验步骤、现象和结论).供选择的试剂:酸性KMnO4溶液、KSCN溶液、氯水.
(5)几种离子开始沉淀时的pH如下表:
| 离子 | Cu2+ | Fe2+ | Mg2+ |
| pH | 5.2 | 7.6 | 10.4 |
分析 氯化铁腐蚀印刷电路铜板后的溶液主要成份为氯化铜、氯化亚铁、氯化铁,要制备氯化铁晶体,根据流程图可知,在“腐蚀废液”中加入过量的铁,则铁将铜置换出来,将三价铁还原成二价铁离子,过滤得滤渣Y为铜和过量的铁,滤液X为氯化亚铁溶液,Y中加入稀盐酸溶解单质铁,滤后得金属铜和滤液Z为氯化亚铁溶液,在X和Z两处的氯化亚铁溶液中通入氯气得到U为氯化铁溶液,所以气体V为氯气,氯化铁溶液经过蒸发浓缩、冷却结晶,过滤、洗涤、干燥得氯化铁晶体,据此答题.
解答 解:氯化铁腐蚀印刷电路铜板后的溶液主要成份为氯化铜、氯化亚铁、氯化铁,要制备氯化铁晶体,根据流程图可知,在“腐蚀废液”中加入过量的铁,则铁将铜置换出来,将三价铁还原成二价铁离子,过滤得滤渣Y为铜和过量的铁,滤液X为氯化亚铁溶液,Y中加入稀盐酸溶解单质铁,滤后得金属铜和滤液Z为氯化亚铁溶液,在X和Z两处的氯化亚铁溶液中通入氯气得到U为氯化铁溶液,所以气体V为氯气,氯化铁溶液经过蒸发浓缩、冷却结晶,过滤、洗涤、干燥得氯化铁晶体,
(1)根据上面的分析可知,试剂W是铁粉,操作Ⅱ为过滤,操作Ⅲ为蒸发浓缩、冷却结晶,都使用的玻璃仪器名称是玻璃棒,其中操作Ⅲ中玻璃棒的作用是搅拌,
故答案为:铁粉;玻璃棒;搅拌;
(2)根据上面的分析可知,气体v是氯气,化学式是Cl2,U为氯化铁溶液,由于铁离子水解生成氢氧化铁,氯化氢易挥发,促使铁离子进一步水解,氢氧化铁受热分解生成氧化铁,所以若将氯化铁溶液加热蒸干灼烧后得到的固体物质是氧化铁,化学式是 Fe2O3,
故答案为:Cl2;Fe2O3;
(3)实验室制取Cl2的反应的离子方程式为MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O;
(4)若通人的Cl2的量不足,则不能将氯化亚铁全部氧化成氯化铁,最后制得的氯化铁晶体不纯净,这是因为氯化铁溶液中含有杂质FeCl2,验证溶液U中的成分,并判断通入的V的量是否不足的实验操作为取少量溶液U,加入几滴KSCN溶液,若溶液显血红色,则表明溶液U中含有Fe3+(或FeCl3),另取少量溶液U,加入几滴酸性KMnO4溶液,若KMnO4溶液褪色,则表明溶液U中含有Fe2+(或FeCl2),说明通人V的量不足,若KMnO4溶液不褪色,说明通人V的量足够,
故答案为:FeCl2;取少量溶液U,加入几滴KSCN溶液,若溶液显血红色,则表明溶液U中含有Fe3+(或FeCl3),另取少量溶液U,加入几滴酸性KMnO4溶液,若KMnO4溶液褪色,则表明溶液U中含有Fe2+(或FeCl2),说明通人V的量不足,若KMnO4溶液不褪色,说明通人V的量足够;
(5)根据题中几种离子开始沉淀时的pH值可知,溶液中滴加NaOH溶液时,Cu2+先沉淀,其次是Fe2+,最后是Mg2+,由于Ksp小的物质先沉淀,所以可知Ksp[Mg(OH)2]>Ksp[Fe(OH)2],
故答案为:Cu2+;>.
点评 本题考查了铁盐、亚铁盐的性质,题目难度不大,注意不同价态铁元素之间的转化是高考的热点,注意相关知识的积累.

| A. | 2a=b | B. | a=2b | C. | 2a<b | D. | a<b<2a |
| A. | 使PH试纸变成红色的溶液,可能存在大量的:NH4+、Cu2+、ClO-、Cl- | |
| B. | (NH4)2Fe(SO4)2溶液中,可能存在大量的:K+、Cu2+、Cl-、MnO4- | |
| C. | 硫酸酸化的淀粉KI溶液在空气中变成蓝色:4I-+O2+2H2O═2I2+4OH- | |
| D. | NaHCO3溶液中滴加少量澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- |
 (1)“冰甲烷”即甲烷的结晶水合物,是一种晶体,该晶体中平均每46个水分子构成8个笼,每个笼可容纳一个甲烷分子或一个游离水分子,若该晶体中每8个笼只有6个容纳甲烷分子,另外2个被游离水分子填充,则“冰甲烷”平均组成可表示为B(填序号).
(1)“冰甲烷”即甲烷的结晶水合物,是一种晶体,该晶体中平均每46个水分子构成8个笼,每个笼可容纳一个甲烷分子或一个游离水分子,若该晶体中每8个笼只有6个容纳甲烷分子,另外2个被游离水分子填充,则“冰甲烷”平均组成可表示为B(填序号).