题目内容
10.用2.7g铝与过量200mL浓度为2mol/L的盐酸反应,回答下列问题:(1)反应消耗多少摩HCl?
(2)在标准状况下产生的气体体积为多少升?
(3)溶液中生成物的物质的量浓度为多少?(假设反应后溶液体积不变)
分析 根据n=$\frac{m}{M}$计算Al的物质的量,盐酸足量,Al完全反应,根据2Al+6HCl=2AlCl3+3H2↑计算消耗HCl物质的量、生成氢气物质的量、生成氯化铝的物质的量,再根据V=nVm计算氢气体积,根据c=$\frac{n}{V}$计算氯化铝的物质的量浓度.
解答 解:2.7g Al的物质的量为$\frac{2.7g}{27g/mol}$=0.1mol,
2 Al+6 HCl=2AlCl3+3H2↑
2 6 2 3
0.1mol x y z
则x=$\frac{0.1mol×6}{2}$=0.3mol
y=$\frac{0.1mol×2}{2}$=0.1mol
z=$\frac{0.1mol×3}{2}$=0.15mol
则标况下生成氢气为0.15mol×22.4L/mol=3.36L
氯化铝的物质的量浓度为$\frac{0.1mol}{0.2L}$=0.5mol/L,
答:(1)反应消耗HCl为0.3mol;
(2)在标准状况下产生的气体体积为3.36L;
(3)溶液中生成物的物质的量浓度为0.5mol/L.
点评 本题考查化学方程式的有关计算,比较基础,旨在考查学生对基础知识的理解掌握.

练习册系列答案
相关题目
20.获得“863”计划支持的环境友好型铝碘电池已研制成功,电解质溶液为AlI3溶液,电池总反应式为2Al+3I2═2AlI3.下列说法不正确的是( )
| A. | 该电池负极的电极反应为:Al-3e-=Al3+ | |
| B. | 电池工作时,溶液中铝离子向正极移动 | |
| C. | 消耗相同质量金属时,用锂作负极产生电子的物质的量比用铝时多 | |
| D. | 当导线中有3.612×1024个电子通过时,电池负极质量减少27g |
5.向含amol NaOH的溶液中通入bmol CO2,溶液中产生Na2CO3的物质的量为( )
①bmol ②amol ③0 ④(a-b)mol ⑤(a+b)mol.
①bmol ②amol ③0 ④(a-b)mol ⑤(a+b)mol.
| A. | ①⑤ | B. | ②③⑤ | C. | ③④⑤ | D. | ①③④ |
15.下列离子检验正确的是( )
| A. | 某溶液中滴入氯化钡溶液,生成白色沉淀,说明原溶液中有SO42- | |
| B. | 某溶液中滴入硝酸银溶液,生成白色沉淀,说明原溶液中有Cl- | |
| C. | 某溶液滴入稀盐酸,生成无色气体,说明原溶液中有CO32- | |
| D. | 某溶液滴入氢氧化钠溶液,生成蓝色沉淀,说明原溶液中有Cu2+ |
2.利用下列反应不能制得较为纯净的括号中的物质的是( )
| A. | 乙烯与氯气加成(1,2-二氯乙烷) | |
| B. | 乙炔先加一分子HCl,再加H2(氯乙烷) | |
| C. | Cl2和苯用FeCl3作催化剂(氯苯) | |
| D. | 等物质的量的Cl2和C2H6在光照条件下(氯乙烷) |
5.实验室以氯化铁腐蚀印刷电路铜板后的溶液(简称“腐蚀废液”)为主要原料来制备氯化铁晶体,从而重新用作腐蚀印刷电路铜板的试剂.该制备流程如图: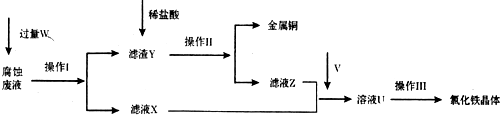
请回答下列问题:
(1)操作Ⅰ和操作Ⅱ相同,其中操作I加入的试剂W是铁粉 (填写名称),操作Ⅱ和操作Ⅲ都使用的玻璃仪器名称是玻璃棒,其中操作Ⅲ中该仪器的作用是搅拌.
(2)进行操作Ⅲ前需要通人气体V,该气体化学式是Cl2,若将溶液U加热蒸干灼烧后得到的固体物质化学式是Fe2O3.
(3)请写出实验室制取气体V的反应的离子方程式:MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O.
(4)若通人的V的量不足,则最后制得的氯化铁晶体不纯净,这是因为溶液U中含有杂质
FeCl2.请设计合理的实验,验证溶液U中的成分,并判断通入的V的量是否不足取少量溶液U,加入几滴KSCN溶液,若溶液显血红色,则表明溶液U中含有Fe3+(或FeCl3),另取少量溶液U,加入几滴酸性KMnO4溶液,若KMnO4溶液褪色,则表明溶液U中含有Fe2+(或FeCl2),说明通人V的量不足,若KMnO4溶液不褪色,说明通人V的量足够 (简要说明实验步骤、现象和结论).供选择的试剂:酸性KMnO4溶液、KSCN溶液、氯水.
(5)几种离子开始沉淀时的pH如下表:
当向含相同浓度Cu2+、Mg2+、Fe2+离子的溶液中滴加NaOH溶液时,Cu2+ (填离子符号)先沉淀,Ksp[Mg(OH)2]>Ksp[Fe(OH)2](填“>”、“=”或“<”).

请回答下列问题:
(1)操作Ⅰ和操作Ⅱ相同,其中操作I加入的试剂W是铁粉 (填写名称),操作Ⅱ和操作Ⅲ都使用的玻璃仪器名称是玻璃棒,其中操作Ⅲ中该仪器的作用是搅拌.
(2)进行操作Ⅲ前需要通人气体V,该气体化学式是Cl2,若将溶液U加热蒸干灼烧后得到的固体物质化学式是Fe2O3.
(3)请写出实验室制取气体V的反应的离子方程式:MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O.
(4)若通人的V的量不足,则最后制得的氯化铁晶体不纯净,这是因为溶液U中含有杂质
FeCl2.请设计合理的实验,验证溶液U中的成分,并判断通入的V的量是否不足取少量溶液U,加入几滴KSCN溶液,若溶液显血红色,则表明溶液U中含有Fe3+(或FeCl3),另取少量溶液U,加入几滴酸性KMnO4溶液,若KMnO4溶液褪色,则表明溶液U中含有Fe2+(或FeCl2),说明通人V的量不足,若KMnO4溶液不褪色,说明通人V的量足够 (简要说明实验步骤、现象和结论).供选择的试剂:酸性KMnO4溶液、KSCN溶液、氯水.
(5)几种离子开始沉淀时的pH如下表:
| 离子 | Cu2+ | Fe2+ | Mg2+ |
| pH | 5.2 | 7.6 | 10.4 |
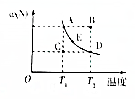 一定条件下,在某密闭恒压容器中发生反应:2M(g)?N(g)△H=a kJ•mol-1,达到平衡时,N的质量分数[ω(N)]与温度的变化关系如图所示:
一定条件下,在某密闭恒压容器中发生反应:2M(g)?N(g)△H=a kJ•mol-1,达到平衡时,N的质量分数[ω(N)]与温度的变化关系如图所示: